Présentation du produit
| Attribut | Détails |
|---|---|
| Chat | CA1030 |
| Taille | 20T / 50T / 100T |
| Stockage | Stocker à 2-8 ° C protégé de la lumière, Ne congelez pas |
| Contenu produit: | 20T | 50T | 100T |
| 4 X (Tampon de liaison 4x) | 4 ml | 10 ml | 20 ml |
| 7-Solution de coloration de viabilité AAD | 0.2 ml | 0.5 ml | 1.0 ml |
| Rh Annexin V / PE | 0.1 ml | 0.25 ml | 0.5 ml |
Présentation du produit:
- Les premiers changements d'apoptose se produisent sur la surface de la membrane cellulaire.
- L'un de ces changements est le transfert de la phosphatidylsérine (Ps) de l'intérieur vers l'extérieur de la membrane cellulaire, exposer PS sur la surface extérieure.
- Ps est un phospholipide chargé négativement principalement sur la surface intérieure de la membrane cellulaire.
- Pendant l'apoptose, L'asymétrie de la distribution des phospholipides est perturbée, exposer PS à l'extérieur.
- L'annexine V se lie facilement à PS et a une forte affinité pour cela, en faisant une sonde sensible pour détecter le PS sur la surface de la membrane cellulaire.
- Le transfert de ps à la membrane externe n'est pas exclusif à l'apoptose mais peut également se produire dans la nécrose cellulaire.
- La principale différence est que la membrane cellulaire reste intacte dans les premiers stades de l'apoptose, alors qu'il est compromis dans la nécrose cellulaire précoce.
- Ainsi, La méthode de double coloration de l'annexine V et 7-AAD peut être utilisée pour détecter l'apoptose cellulaire précoce via la cytométrie en flux.
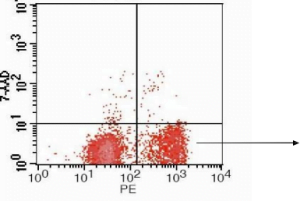
Analyse cytométrique en flux des cellules Jurkat en utilisant l'annexine V-PE / 7AAD après avoir induit l'apoptose avec le cisplatine
Méthode de fonctionnement: (pour référence seulement)
- Préparation des échantillons de cellules:
- Pour les cellules adhérentes: Collectez soigneusement le milieu de culture cellulaire dans un tube à centrifugeuse pour digérer plus tard les cellules avec de la trypsine sans EDTA. Lorsque les cellules peuvent être doucement pipetées avec une pipette ou une pointe de pipette, Ajouter la solution de culture cellulaire précédemment collectée, pipette sur toutes les cellules adhérentes, et souffler doucement les cellules. Collectez à nouveau dans le tube à centrifugeuse. Centrifuger à environ 1000 tr/min pour 5 Minutes pour plonger les cellules. Pour des cellules spécifiques, Si les cellules ne peuvent pas être complètement centrifugées au fond du tube à centrifugeuse, Vous pouvez prolonger de manière appropriée le temps de centrifugeuse ou augmenter légèrement la force centrifuge. Aspirer soigneusement le surnageant. Environ 50 μl de liquide de culture peuvent rester pour éviter d'aspirer les cellules. Ajouter environ 1 ml de 4 ℃ PBS pré-refroidi, remettre en suspension les cellules, centrifugeuse à nouveau pour plonger les cellules, et aspirer soigneusement le surnageant;
- Pour les cellules de suspension: Centrifuger à environ 1000 tr/min pour 5 Minutes pour plonger les cellules. Pour des cellules spécifiques, Si les cellules ne peuvent pas être complètement centrifugées au fond du tube à centrifugeuse, Vous pouvez prolonger de manière appropriée le temps de centrifugeuse ou augmenter légèrement la force centrifuge. Aspirer soigneusement environ 50 μl de liquide de culture qui peut rester pour éviter d'aspirer les cellules. Ajouter environ 1 ml de 4 ℃ PBS pré-refroidi, remettre en suspension les cellules, centrifugeuse à nouveau pour plonger les cellules, et aspirer soigneusement le surnageant;
- Diluer le tampon de liaison 1:3avec de l'eau désionisée (4tampon de liaison ML 4x + 12Ml d'eau déionisée);
- Réus en suspension des cellules avec un tampon de liaison 1x et ajustez la concentration à 1-5 × 106 / ml;
- Prenez 100 µl de suspension cellulaire dans un tube d'écoulement de 5 ml, Ajouter 5 µl d'annexine V / PE pour bien mélanger, et incuber pour 5 minutes à température ambiante dans l'obscurité;
- Ajouter 10 µl de 20UG / ml 7AAD et 400 µl de PBS pour effectuer une détection de débit
Conception expérimentale:
-
Cellules non transfectées
- Tube vierge: Cellules témoins négatives, sans annexine v / pe, 7Extrêmement, utilisé pour ajuster la tension.
- Tube de coloration unique: cellules témoins positives, Seulement avec l'annexine V / PE ou seulement 7AAD pour l'ajustement et la compensation.
- Tube de détection: cellules traitées, Ajouter l'annexine V / PE, 7Extrêmement. Après avoir réglé la compensation de tension avec le tube vide et le tube de colorant unique, Les données de flux requises peuvent être obtenues.
-
Transfection avec GFP
- Tube vide non transfecté: cellules non transfectées, sans annexine v / pe, 7Extrêmement, ont été utilisés pour ajuster la tension.
- Tube à colocage unique non traduit: Pour les cellules non transfectées avec une apoptose évidente, Ajoutez uniquement de l'annexine V / PE ou seulement 7AAD pour l'ajustement et la compensation.
- Transfection du tube vide GFP: Transfecter les cellules de contrôle GFP sans annexine v / pe, 7AAD pour l'ajustement et la compensation.
- Tube de détection: cellules traitées, plus Annexin V / PE, 7Extrêmement. Après avoir ajusté la compensation de tension, Obtenez les données de streaming requises.
Précautions:
- Annexinv est compatible avec la phosphatidylsérine (Ps), et ps n'a aucune différence entre différentes espèces. Dans les cellules normales, Ps n'est distribué que sur le côté intérieur de la bicouche lipidique de la membrane cellulaire. Au début de l'apoptose, PS se tourne du côté intérieur de la membrane lipidique du côté extérieur.
- Digest avec trypsine à faible concentration, Soufflez doucement les cellules adhérentes 2 à 3 fois, et centrifugeuse à 4 ° C 1000 tr/min pour 5 minutes, Si géré correctement, Les dommages causés par la trypsine peuvent être contrôlés à l'intérieur 5%. S'il y a un groupe témoin, Les résultats expérimentaux ne provoqueront pas d'importance
- Ajouter PI d'abord. Non seulement il est difficile de juger si la coloration est uniforme et suffisante pour chaque groupe, Mais Pi lui-même est également toxique pour les cellules et aura un impact plus important sur les résultats expérimentaux que la pancréatine. Ce n'est pas recommandé.
- Annexinv est une protéine dépendante du Ca, L'EDTA ne peut donc pas être ajouté pour empêcher l'EDTA de chélater les ions CA et affectant ainsi l'annexine V, affectant ainsi le
- Lors de l'utilisation de la cytométrie en flux pour détecter l'apoptose, 7Aad est grandement affecté par le temps. Parce que 7aad est étiqueté, Cela augmentera la cytotoxicité. Au fil du temps, Cela augmentera la coloration de 7aad, surtout lors de la détection de l'apoptose précoce. En plus d'augmenter l'écart entre les populations de cellules sur le cytomètre en flux, L'erreur augmentera considérablement. En général, 7AAD est ajouté et la machine est immédiatement sur la machine, Et puis le test est terminé dans les deux méthodes est OK, Mais l'erreur causée par le suivi de nos étapes de fonctionnement sera plus petite.
Littérature connexe:
[1] Ruifeng Zhao, Jing Jin, Xinyu soleil, et autres. L'établissement d'une lignée cellulaire de fibroblaste embryonnaire de poulet dérivée clonale (CSC) avec une efficacité et une capacité de transfection élevée en tant que cellule d'alimentation. Journal of Cellular Biochemistry. Août 2018. (SI 2.959)


Commentaires
Il n'y a pas encore de critiques.