제품개요
| 기인하다 | 세부 |
|---|---|
| 고양이 | CA1030 |
| 크기 | 20T/50T/100T |
| 저장 | 빛으로부터 보호 된 2-8 ° C로 보관하십시오, 얼지 마십시오 |
| 제품 내용: | 20티 | 50티 | 100티 |
| 4 엑스 (결합 완충액 4x) | 4 밀리리터 | 10 밀리리터 | 20 밀리리터 |
| 7-AAD 생존력 염색 솔루션 | 0.2 밀리리터 | 0.5 밀리리터 | 1.0 밀리리터 |
| Rh Annexin V/PE | 0.1 밀리리터 | 0.25 밀리리터 | 0.5 밀리리터 |
제품소개:
- 세포 자멸사의 초기 변화는 세포막 표면에서 발생합니다..
- 이러한 변화 중 하나는 포스파티딜 세린의 전달입니다 (추신) 내부에서 세포막의 외부로, 외부 표면에 PS를 노출시킵니다.
- PS는 주로 세포막의 내부 표면에서 발견되는 음으로 하전 된 인지질이다..
- 아 pop 토 시스 동안, 인지질 분포의 비대칭이 중단됩니다, 외부에서 PS를 노출시킵니다.
- Annexin V는 PS에 쉽게 결합하고 그것에 대해 높은 친화력을 가지고 있습니다., 세포막 표면에서 PS를 감지하기위한 민감한 프로브로 만듭니다..
- PS 외막으로의 PS 전달은 세포 자멸사에만 전적형이 아니지만 세포 괴사에서도 발생할 수 있습니다..
- 주요 차이점은 세포막이 아 pop 토 시스의 초기 단계에서 그대로 유지된다는 것입니다., 반면에 그것은 초기 세포 괴사에서 손상됩니다.
- 따라서, 유세포 분석법을 통해 초기 세포 아 pop 토 시스를 검출하기 위해 Annexin V 및 7-AAD의 이중 염색 방법을 이용할 수 있습니다..
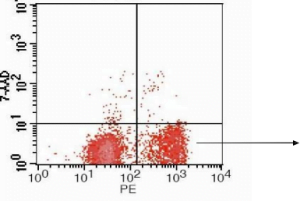
시스플라틴과의 아 pop 토 시스를 유도 한 후 아 넥신 V-PE/7AAD를 사용한 Jurkat 세포의 유세포 분석 분석
작동 방법: (참고용으로만)
- 세포 샘플의 준비:
- 부착 된 세포를 위해: 세포 배양 배지를 원심 분리 튜브에 조심스럽게 수집하여 나중에 EDTA없이 트립신으로 세포를 소화합니다.. 셀을 피펫이나 피펫 팁으로 부드럽게 피펫 팅 할 수있는 경우, 이전에 수집 된 세포 배양 솔루션을 추가하십시오, 모든 부착 세포를 피펫칩니다, 그리고 세포를 부드럽게 날려 버립니다. 원심 분리 튜브에 다시 수집하십시오. 약한 원심 분리 1000 rpm 5 세포를 펠릿으로하는 분. 특정 세포의 경우, 세포를 원심 분리 튜브의 바닥에 완전히 원심 분리 할 수없는 경우, 원심 분리 시간을 적절하게 연장하거나 원심력을 약간 증가시킬 수 있습니다.. 상청액을 조심스럽게 흡인하십시오. 약 50μl의 배양액은 세포의 흡인을 피하기 위해 남아있을 수 있습니다.. 약 1ml의 4 ℃ 사전 냉각 된 PBS를 추가하십시오, 세포를 재활용하십시오, 다시 원심 분리하여 세포를 펠릿합니다, 상청액을 조심스럽게 흡인합니다;
- 서스펜션 셀의 경우: 약한 원심 분리 1000 rpm 5 세포를 펠릿으로하는 분. 특정 세포의 경우, 세포를 원심 분리 튜브의 바닥에 완전히 원심 분리 할 수없는 경우, 원심 분리 시간을 적절하게 연장하거나 원심력을 약간 증가시킬 수 있습니다.. 세포의 흡인을 피하기 위해 남아있을 수있는 약 50μl의 배양액을 조심스럽게 흡인합니다.. 약 1ml의 4 ℃ 사전 냉각 된 PBS를 추가하십시오, 세포를 재활용하십시오, 다시 원심 분리하여 세포를 펠릿합니다, 상청액을 조심스럽게 흡인합니다;
- 결합 완충액을 희석시킵니다 1:3탈 이온수로 (4ML 4X 결합 완충액 + 12ML 탈 이온수);
- 1x 결합 완충제로 세포를 재현 탁하고 농도를 1-5 × 106/ml로 조정하십시오.;
- 5ml 흐름 튜브에 100µl의 셀 현탁액을 가져옵니다., 잘 혼합하려면 5μl Annexin V/PE를 추가하십시오, 인큐베이트 5 어둠 속에서 실온에서 분;
- 유동 감지를 수행하기 위해 10UG/mL 7AAD 및 400μl의 PBS를 추가하십시오.
실험 설계:
-
감염되지 않은 세포
- 빈 튜브: 음성 대조군 셀, Annexin V/PE없이, 7극도로, 전압을 조정하는 데 사용됩니다.
- 단일 염색 튜브: 양성 대조군 세포, 조정 및 보상을 위해 Annexin V/PE 또는 7AAD 만으로만.
- 탐지 튜브: 처리 된 세포, Annexin V/PE를 추가하십시오, 7극도로. 빈 튜브 및 단일 염료 튜브로 전압 보정을 조정 한 후, 필요한 유량 데이터를 얻을 수 있습니다.
-
GFP 로의 형질 감염
- 변환되지 않은 빈 튜브: 감염되지 않은 세포, Annexin V/PE없이, 7극도로, 전압을 조정하는 데 사용되었습니다.
- 변환되지 않은 단일 스테인드 튜브: 명백한 아 pop 토 시스를 가진 형질 감염되지 않은 세포의 경우, 조정 및 보상을 위해 아 넥신 V/PE 또는 7AAD 만 추가하십시오..
- GFP 블랭크 튜브의 형질 감염: 아 넥신 V/PE가없는 수혈 GFP 대조군 세포, 7조정 및 보상을위한 AAD.
- 탐지 튜브: 처리 된 세포, 플러스 annexin v/pe, 7극도로. 전압 보정을 조정 한 후, 필요한 스트리밍 데이터를 얻습니다.
지침:
- Annexinv는 포스파티딜 세린과 호환됩니다 (추신), 그리고 PS는 다른 종들 사이에 차이가 없다. 정상 세포에서, PS는 세포막의 지질 이중층의 안쪽에만 분포됩니다.. 아 pop 토 시스의 초기 단계에서, PS는 지질막의 안쪽에서 바깥쪽으로 돌립니다..
- 농도가 낮은 트립신으로 소화하십시오, 부착 된 세포를 부드럽게 날려 버립니다 2 에게 3 타임스, 및 4 ℃에서 원심 분리 1000 rpm 5 분, 제대로 처리 된 경우, 트립신으로 인한 손상은 내부에서 제어 할 수 있습니다 5%. 제어 그룹이있는 경우, 실험 결과는 크게 유발되지 않습니다
- 먼저 PI를 추가하십시오. 염색이 각 그룹에 대해 균일하고 충분한 지 판단하기가 어렵을뿐만 아니라, 그러나 PI 자체는 또한 세포에 독성이 있으며 Pancreatin보다 실험 결과에 더 큰 영향을 미칩니다.. 권장하지 않습니다.
- Annexinv는 Ca- 의존성 단백질입니다, 따라서 EDTA가 CA 이온을 킬링하는 것을 방지하기 위해 EDTA를 추가 할 수 없습니다. 따라서 Annexin V에 영향을 미칩니다., 따라서 영향을 미칩니다
- 유세포 분석을 사용하여 아 pop 토 시스를 검출 할 때, 7AAD는 시간에 크게 영향을받습니다. 7AAD가 표시되어 있기 때문입니다, 세포 독성을 증가시킵니다. 시간이 지남에 따라, 7AAD의 염색이 증가합니다, 특히 초기 아 pop 토 시스를 검출 할 때. 유세포 분석기에서 세포 집단 간의 간격을 증가시키는 것 외에도, 오류가 크게 증가합니다. 일반적으로, 7AAD가 추가되고 기계가 즉시 기계에 있습니다., 그런 다음 테스트는 두 가지 방법 모두에서 완료됩니다., 그러나 우리의 운영 단계를 따르는 오류는 더 작습니다..
관련 문헌:
[1] Ruifeng Zhao, Jing Jin, Xinyu Sun, 외. 클로어 유래 닭 배아 섬유 아세포 세포주의 확립 (CSC) 피더 셀로 높은 형질 감염 효율과 능력. 세포 생화학 저널. 팔월 2018. (만약에 2.959)



상품평
아직 상품평이 없습니다.