กลูตาไธโอนลดลง (จีเอสเอช) ชุดทดสอบเนื้อหา
บันทึก: ใช้ตัวอย่างที่แตกต่างกันสองหรือสามตัวอย่างเพื่อทำนายก่อนการทดสอบ.
อุปกรณ์การดำเนินงาน: เครื่องสเปกโตรโฟโตมิเตอร์/เครื่องอ่านไมโครเพลท
หมายเลขแค็ตตาล็อก: BC1175
ขนาด: 100ที/96ส
ส่วนประกอบ:
รีเอเจนต์ I: 100 มล.×1. เก็บที่อุณหภูมิ 4 ℃.
รีเอเจนต์ II: 20 มล.×1. เก็บที่อุณหภูมิ 4 ℃.
รีเอเจนต์ III: 8 มล.×1. เก็บที่อุณหภูมิ 4 ℃, ป้องกันแสง.
มาตรฐาน: ผง 10 มก.×1. เก็บที่อุณหภูมิ 4 ℃, ป้องกันแสง.
รายละเอียดสินค้า
กลูตาไธโอนเป็น tripeptide ธรรมชาติที่ประกอบด้วยกรดกลูตามิก (กลู), ซีสเตอีน (ซิส) และไกลซีน (กล้ามเนื้อ). มันเป็นสารประกอบที่มีกลุ่ม sulfhydryl (-SH), ซึ่งมีอยู่อย่างกว้างขวางในเนื้อเยื่อสัตว์, เนื้อเยื่อพืช, จุลินทรีย์, และยีสต์. กลูตาไธโอนสามารถทำปฏิกิริยากับ 5,5′-dithiobis-(2-กรดไนโตรเบนโซอิก) (ดีทีเอ็นบี) เพื่อผลิตกรด 2-nitro-5-mercaptobenzoic และกลูตาไธโอนซัลไฟด์ (จีเอสเอสจี). 2-Nitro-5-mercaptobenzoic acid เป็นผลิตภัณฑ์สีเหลือง, ด้วยการดูดซึมสูงสุดที่ 412 นาโนเมตร.
ข้อกำหนดทางเทคนิค
ขีดจำกัดการตรวจจับขั้นต่ำ:3.763 มก./มล
ช่วงเชิงเส้น:12.5-400 มก./มล
รีเอเจนต์และอุปกรณ์ที่จำเป็นแต่ไม่ได้จัดเตรียมไว้ให้
ความสมดุลเชิงวิเคราะห์, ปูน/โฮโมจีไนเซอร์, เครื่องหมุนเหวี่ยงอุณหภูมิต่ำ, อ่างอาบน้ำ, ปิเปตแบบปรับได้, เครื่องสเปกโตรโฟโตมิเตอร์/เครื่องอ่านไมโครเพลท, Micro Glass Cuvette หรือ 96 แผ่นด้านล่างแบนและน้ำกลั่น.
ขั้นตอน
ฉัน. การจัดเตรียมตัวอย่าง
- ตัวอย่างเนื้อเยื่อ
ล้างทิชชู่สดด้วย PBS สองครั้ง, จากนั้นเพิ่ม 0.1 G ของเนื้อเยื่อสัตว์/พืชเป็น homogenizer (โฮโมจีไนเซอร์ถูกล้างด้วยรีเอเจนต์ I แล้ววางบนน้ำแข็งก่อนใช้งาน). เพิ่ม 1 มิลลิลิตรของรีเอเจนต์ I (สัดส่วนของเนื้อเยื่อและรีเอเจนต์สามารถรักษาได้คงที่), บดน้ำแข็งจนสุด (การใช้ไนโตรเจนเหลวจะมีผลการบดที่ดีกว่า). เครื่องปั่นแยกที่ 8000 ×กรัม สำหรับ 10 นาทีที่ 4 ℃, นำส่วนเหนือตะกอนมาวางไว้ที่อุณหภูมิ 4 ℃เพื่อทำการทดสอบ. (หากไม่สามารถทำการทดสอบให้แล้วเสร็จได้ชั่วคราว, สามารถเก็บไว้ได้ที่ -80 ℃สำหรับ 10 วัน)
- ตัวอย่างเลือด
พลาสมา: ตัวอย่างถูกปั่นเหวี่ยงที่ 600 ×กรัม สำหรับ 10 นาทีที่ 4 ℃. การดูดซับพลาสม่าส่วนบนลงในหลอดอื่นด้วยการเพิ่มน้ำยาปรับระดับเสียงเดียวกัน i. เครื่องปั่นแยกที่ 8000 ×กรัม สำหรับ 10 นาทีที่ 4 ℃, ใช้ supernatant และวางไว้ที่ 4 ℃สำหรับการทดสอบ. (หากไม่สามารถทำการทดสอบให้แล้วเสร็จได้ชั่วคราว, สามารถเก็บไว้ได้ที่ -80 ℃สำหรับ 10 วัน)
เซลล์เม็ดเลือด: ตัวอย่างถูกปั่นเหวี่ยงที่ 600 ×กรัม สำหรับ 10 นาทีที่ 4 ℃. การทิ้งพลาสมาส่วนบน, ล้างด้วยปริมาณ PBS สามเท่าสำหรับ 3 ครั้ง (ระงับเซลล์เม็ดเลือดอีกครั้งด้วย PBS, เครื่องหมุนเหวี่ยงที่ 600 ×กรัม สำหรับ 10 นาที), เพิ่มปริมาตรรีเอเจนต์ I ที่เท่ากัน. หลังจากผสมแล้ว, วางไว้ที่ 4 ℃สำหรับ 10 นาที. เครื่องปั่นแยกที่ 8000 ×กรัม สำหรับ 10 นาที, นำส่วนเหนือตะกอนมาวางไว้ที่อุณหภูมิ 4 ℃เพื่อทำการทดสอบ. (หากไม่สามารถทำการทดสอบให้แล้วเสร็จได้ชั่วคราว, สามารถเก็บไว้ได้ที่ -80 ℃สำหรับ 10 วัน)
3. เซลล์ ตัวอย่าง
เซลล์เก็บเกี่ยวไม่ควรน้อยกว่า 106 จากนั้นล้างด้วย PBS เป็นสองเท่า (ระงับเซลล์อีกครั้งด้วย PBS, เครื่องหมุนเหวี่ยงที่ 600 ×กรัม สำหรับ 10 นาที). ปริมาตรของรีเอเจนต์ที่ฉันเพิ่มคือสามเท่าของปริมาณการตกตะกอนของเซลล์เพื่อระงับเซลล์อีกครั้ง. การแช่แข็งและละลายซ้ำ 2-3 ครั้ง (แนะนำว่าแช่แข็งในไนโตรเจนเหลว, ละลายในอ่างน้ำอุณหภูมิ 37°C). เครื่องปั่นแยกที่ 8000 ×กรัม สำหรับ 10 นาที, นำส่วนเหนือตะกอนมาวางไว้ที่อุณหภูมิ 4 ℃เพื่อทำการทดสอบ. (หากไม่สามารถทำการทดสอบให้แล้วเสร็จได้ชั่วคราว, สามารถเก็บไว้ได้ที่ -80 ℃สำหรับ 10 วัน)
ครั้งที่สอง. ขั้นตอน
- เปิดเครื่องสเปกโตรโฟโตมิเตอร์/เครื่องอ่านไมโครเพลทสำหรับ 30 นาที, ปรับความยาวคลื่นเป็น 412 นาโนเมตร, ตั้งค่าศูนย์ด้วยการกลั่น
- เปิดรีเอเจนต์อุ่น II ใน 37 ℃ (เซลล์สัตว์เลี้ยงลูกด้วยนม) หรือ 25 ℃ (สายพันธุ์อื่น) อ่างน้ำสำหรับ 30
- การกำหนดท่อเปล่า: ใช้แก้วขนาดเล็ก cuvette, เพิ่ม 20 น้ำกลั่น ไมโครลิตร, 140 μL ของรีเอเจนต์ II, 40 μlของ Reagent III ในทางกลับกัน, ผสมให้เข้ากัน, สถานที่ 2 นาที, และวัด 412 NM การดูดซับ AB.
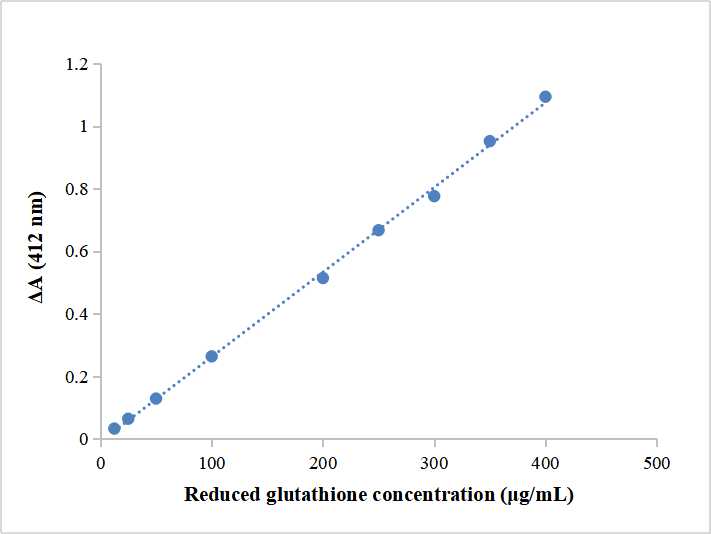
- สร้างเส้นโค้งมาตรฐาน
ชั่งน้ำหนัก 1 mg ของมาตรฐานและละลายด้วย 1 ML ของน้ำกลั่นเพื่อให้ได้ความเข้มข้นของ 1 มก./มล. ใช้วิธีแก้ปัญหาที่เหมาะสมเพื่อเตรียมมาตรฐานด้วยความเข้มข้นของ 200 มก./มล, 100 มก./มล, 50 มก./มล, 25 μg/ml และ 12.5 มก./มล (เจือจางรีเอเจนต์ฉันสิบครั้งก่อนเจือจางสารละลายมาตรฐาน).
ใช้ 1.5 หลอด ML EP และเพิ่ม 20 μlของมาตรฐาน, 140 μlของน้ำยา II และ 40 μlของ Reagent III ในทางกลับกัน. หลังจากแต่ละหลอดผสมกันอย่างสม่ำเสมอ, ได้รับอนุญาตให้ยืนหยัดเพื่อ 2 นาที. วัดค่าการดูดกลืนแสงที่ 412 นาโนเมตร, และการดูดซับลบ AB เป็น abscissa. สร้างเส้นโค้งมาตรฐานตามการดูดซับ (x) และสมาธิ (ย, มก./มล).
- ตัวอย่างการทดสอบหลอด: ใช้แก้วขนาดเล็ก cuvette, เพิ่ม 20 μlของตัวอย่าง, 140 μL ของรีเอเจนต์ II, 40 μlของ Reagent III ในทางกลับกัน, ผสมให้เข้ากัน, จากนั้นยืนหยัดเพื่อ 2 นาทีเพื่อทดสอบ Atat การดูดกลืนแสง 412 นาโนเมตร, ∆A = AT – เอบี.
- การทำงานของเครื่องอ่านไมโครเพลทนั้นเหมือนกับของเครื่องสเปกโตรโฟโตมิเตอร์, และการดำเนินการนั้นเร็วเท่ากับ
สาม. การคำนวณ
ตามเส้นโค้งมาตรฐาน, นำตัวอย่างΔAเข้าสู่สูตร(x), และคำนวณความเข้มข้นตัวอย่าง y (มก./มล).
- ความเข้มข้นของโปรตีน
จีเอสเอช (ไมโครกรัม/มิลลิกรัมโปรต)= y × vrv ÷ vrv ÷ cpr = y ÷ cpr
- น้ำหนักตัวอย่าง
จีเอสเอช (μg/g)= y × vrv ÷(VRV ÷ VSV × W)= y۞W
- จำนวนเซลล์
จีเอสเอช (μg/104cell)= y × vrv ÷(VRV ÷ VSV × N)= y۞N
- ปริมาณโซลูชัน GSH (มก./มล)= 2y
เอ็น: จำนวนเซลล์, 106;
VSV: ปริมาตรส่วนเกิน, 1 มล;
สาย: ปริมาตรส่วนเกินที่เพิ่มเข้ามาในระบบปฏิกิริยา, 20 ไมโครลิตร=0.02 มล; ว: น้ำหนักตัวอย่าง, ก;
ซีพีอาร์: ความเข้มข้นของโปรตีนเหนือตะกอน, มก./มล.
2: ปริมาณพลาสมา (เซลล์เม็ดเลือด) ถูกเจือจางโดยครั้งเดียว.
บันทึก:
- ตัวอย่างจะต้องทำให้เป็นเนื้อเดียวกันโดยสมบูรณ์. หากไม่สามารถทำการทดสอบให้แล้วเสร็จได้ชั่วคราว, สามารถเก็บไว้ที่ -80 ℃.
- มาตรฐาน: กลูตาไธโอนที่ลดลงจะถูกเตรียมเมื่อสารละลายจะเป็น
- หากเนื้อหา GSH ในตัวอย่างไม่แน่นอน, เจือจางตัวอย่างสำหรับการไล่ระดับสีหลายครั้งก่อน
- เพราะน้ำยาฉันมีโปรตีนตกตะกอน, ไม่สามารถใช้ supernatant สำหรับการกำหนดความเข้มข้นของโปรตีน. หากจำเป็นต้องกำหนดปริมาณโปรตีน, เอาเนื้อเยื่ออีกอัน.
อ้างอิง:
- อัลเพิร์ต เอ เจ, กิลเบิร์ต เอช เอฟ. การตรวจหากลูตาไธโอนที่ถูกออกซิไดซ์และรีดิวซ์ด้วยปฏิกิริยาหลังการรีไซเคิล[เจ]. ชีวเคมีวิเคราะห์, 1985, 144(2):553-562.
- โอเวนส์ ซี ดับเบิลยู ไอ, Belcher R V. micro-micro-micro-micro-method สำหรับการกำหนดกลูตาไธโอน[เจ]. วารสารชีวเคมี, 1965, 94(3):
สินค้าที่เกี่ยวข้อง:
BC1180/ BC1185 กลูตาไธโอนออกซิไดซ์ (GSSG) ชุดทดสอบ
BC1190/ BC1195 ชุดทดสอบกลูตาไธโอนเปอร์ออกซิเดส
BC1150/ BC1155 ออกซิไดซ์ thioredoxin reductase (TRXR) ชุดทดสอบ
BC1210/ BC1215 γ-glutamate-cysteine ligase (GCL) assay ki



รีวิว
ยังไม่มีบทวิจารณ์