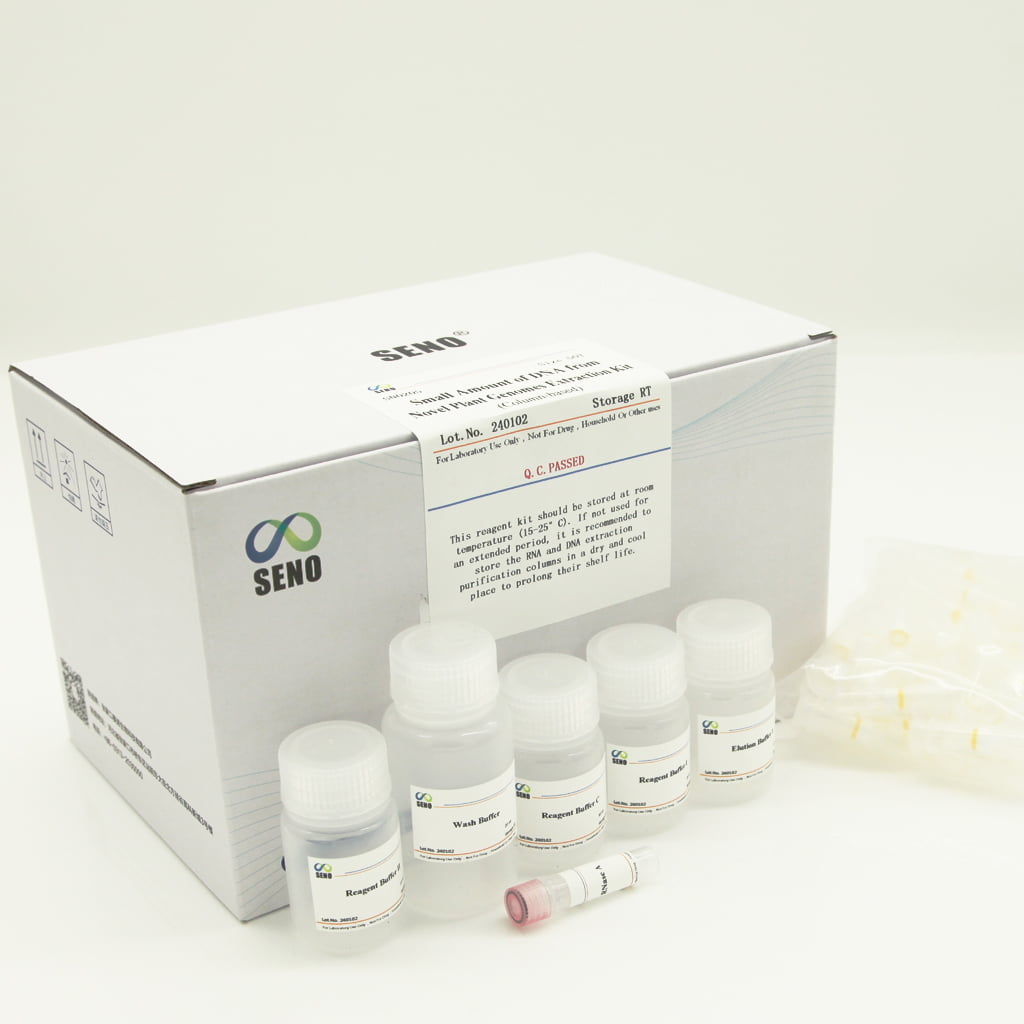
- Composants du kit de réactifs
| Caractéristiques | 50T | 100T |
| Chat. Non. | SN0205 | SN0206 |
| Colonnes d'extraction d'ADN (ensemble) | 50 (ensemble) | 100 (ensemble) |
| Reagent Buffer I | 20 ml | 2×20 ml |
| Reagent Buffer II | 15 ml | 15 ml |
| Tampon réactif C | 30 ml | 2 × 30 ml |
| Tampon d'élution 1 | 15 ml | 2 × 15 ml |
| Tampon de lavage | 20 ml | 20 ml |
| RNase A | 1ml | 1ml |
| Manuel d'instructions | 1 | 1 |
- Stockage
Ce kit doit être conservé à température ambiante (15-25℃) dans des conditions sèches et peut être stocké pendant 12 mois. Les colonnes de purification par extraction d'ADN peuvent être stockées dans un environnement frais et sec jusqu'à 1 année. La RNase A contient un conservateur et peut être transportée à température ambiante, mais pour un stockage à long terme, il doit être maintenu à -20 ℃.
- Instructions d'utilisation du kit de réactifs
3.1 Ce kit est destiné à des fins de recherche en biologie moléculaire et ne doit pas être utilisé pour le diagnostic ou le traitement de maladies..
3.2 Certains composants du kit contiennent des irritants; il est conseillé de prendre les précautions nécessaires (comme porter des vêtements de protection et des lunettes).
3.3 L'utilisation de ce kit nécessite un équipement supplémentaire tel qu'une centrifugeuse à grande vitesse, bain d'eau (bain en métal), mélangeur de vortex, éthanol anhydre, l'azote liquide, chloroforme, eau déminéralisée stérile, et tubes EP.
- Introduction au kit de réactifs
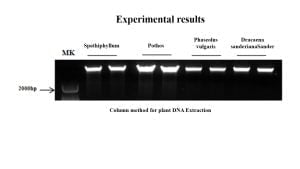
The new plant genome Purification de l'ADN kit provides a rapid method for DNA purification. It effectively precipitates DNA with specific reagent buffers II and C, collecting high-purity DNA through adsorption columns.
This kit is widely applicable for isolating samples from plant tissues and fungi, enabling the extraction of total DNA from plants and fungi within 30 minutes. The extraction process doesn’t involve toxic reagents like phenol-chloroform. L'ADN extrait peut être directement utilisé pour des expériences en aval telles que RAP et Southern blot.
- Principes et procédures expérimentaux:

- Processus d'extraction
Précautions avant de commencer l'expérience:
UN. Reagent Buffer I and Reagent Buffer C tend to precipitate at low temperatures. Il est recommandé de les chauffer à 65 ° C pour 5 minutes until the precipitates dissolve before normal usage.
B. Avant d'utiliser Tampon de lavage 1, add the specified amount of absolute ethanol as indicated on the reagent bottle label and mark a check (√) on the label to indicate the addition of absolute ethanol.
C. Le tampon d'élution est un 0.1x solution TE containing a minimal amount of EDTA. Si l'EDTA affecte les expériences ultérieures, it is recommended to substitute the Elution Buffer with sterile deionized water.
1. Traitement des échantillons:
UN. Collecte et stockage des matériaux
If freshly collected materials cannot be immediately used, place them in liquid nitrogen for cooling and finally store at -80°C. Les matériaux séchés peuvent être stockés à température ambiante.
B. If conditions permit, collect fresh materials whenever possible, as fresh materials contain fewer polysaccharides and polyphenols.
C. Lors de la collecte de champignons à partir d'une culture liquide, separate the liquid and collect the fungal cells by centrifugation.
2. Weigh around 100 mg of fresh samples or not exceeding 20 mg of dry material and grind it with liquid nitrogen.
(Note: Different sample amounts may vary; it is advisable to optimize the sample amount through pre-experimental trials.)
3. Ajouter 400μl Reagent Buffer I and 10μl RNaseA (10 mg/ml), ensuring there are no clumps in the ground sample. Clumps are difficult to lyse, reducing the DNA yield. Aussi, do not mix Reagent Buffer I and RNaseA before usage.
4. Incuber à 65°C pendant 5 minutes, gently invert the mixture 2-3 fois. This step is used for cell lysis. If samples are difficult to lyse, extend the incubation time, but not beyond 30 minutes.
5. Ajouter 130μl Reagent Buffer II et bien mélanger, then ice-bathe for 5 minutes (this step is used for precipitating polysaccharides and proteins).
6. Centrifuger le lysat pour 5 minutes à 14,000 tr/min (20,000×g).
(Note: Some plant materials may contain a lot of viscous substances at this step, which can shear DNA in the subsequent steps. Donc, the ideal state is to remove these substances during this step. Après centrifugation, Transférer le surnageant dans un nouveau tube à centrifugeuse. If there is a significant amount of flocculent material in the supernatant after centrifugation, it indicates that the initial sample quantity was too large. Consider reducing the initial sample amount.)
7. Carefully transfer the obtained liquid to a new centrifuge tube.
(Note: Approximately 450μl of liquid can be transferred; pour certaines espèces, it may be less than 450μl.)
8. Ajoutez un volume égal de Tampon réactif C and an equal volume of absolute ethanol to the lysate and mix well.
(Par exemple: Add 450μl of Reagent Buffer C, then add 450μl of absolute ethanol. If the volume of the lysate is less than 450μl, reduce the amount of Reagent Buffer C proportionally. Adding Reagent Buffer C will cause slight precipitation, Mais cela n'affectera pas les expériences ultérieures.)
9. Ajouter le liquide obtenu à la colonne de purification d'extraction d'ADN (trousse) (environ 650-700μl à chaque fois), centrifuge at greater than 8,000 tr/min pour 1 minute, jeter les déchets collectés, et réinsérez le tube de collecte dans la colonne de purification pour l'étape suivante.
10. Répétez l'étape 9, add the remaining liquid to the DNA extraction purification column (trousse), centrifuge at greater than 8,000 tr/min pour 1 minute, discard waste and the collection tube.
11. Placer la colonne de purification d'extraction d'ADN (trousse) dans le tube de collection, ajouter 300µl de tampon de lavage 1,centrifuge at greater than 8,000 tr/min pour 1 minute, discard waste, et placez la colonne de purification d'extraction d'ADN (trousse) back into the tube for the next step.
(Note: Confirm the addition of absolute ethanol in Wash Buffer 1.)
12. Ajouter 500µl de tampon de lavage 1 à la colonne de purification d'extraction d'ADN (trousse), centrifuger à 14,000 tr/min (20,000×g) pour 2 minutes, extend centrifugation time appropriately to ensure the membrane is adequately dry.
13. Placer la colonne de purification d'extraction d'ADN (trousse) dans un nouveau tube à centrifuger, leave it uncovered, et incuber à 65°C pendant 2 minutes. Extend this step as needed to evaporate ethanol to prevent ethanol residue from affecting downstream experiments.
14. Pipette 100µl de tampon d'élution sur la membrane de colonne, centrifuger à 12,000 tr/min pour 2 minutes.
(Note: 1. Using 50μl of Elution Buffer to elute DNA can increase DNA concentration but reduce the overall DNA yield; 2. The eluate containing DNA can be reapplied to the DNA extraction purification column and centrifuged at 12,000 tr/min pour 2 minutes again to increase DNA yield.)






Commentaires
Il n'y a pas encore de critiques.