Обзор продукта
| Атрибут | Подробности |
|---|---|
| Кот | CA1030 |
| Размер | 20T/50t/100t |
| Хранилище | Хранить при 2-8 ° C, защищенной от света, Не замораживайте |
| Содержание продукта: | 20Т | 50Т | 100Т |
| 4 Икс (Связывающий буфер 4x) | 4 мл | 10 мл | 20 мл |
| 7-Окрашивание жизнеспособности AAD | 0.2 мл | 0.5 мл | 1.0 мл |
| RH Аннексин V/PE | 0.1 мл | 0.25 мл | 0.5 мл |
Внедрение продукции:
- Ранние изменения апоптоза происходят на поверхности клеточной мембраны.
- Одним из этих изменений является перенос фосфатидилсерина (Пса) изнутри на внешнюю часть клеточной мембраны, разоблачение PS на внешней поверхности.
- PS является отрицательно заряженным фосфолипидом, в основном обнаруженным на внутренней поверхности клеточной мембраны.
- Во время апоптоза, асимметрия распределения фосфолипидов нарушена, разоблачение PS снаружи.
- Аннексин V легко связывается с PS и имеет высокое сродство к нему, Сделать его чувствительным зондом для обнаружения PS на поверхности клеточной мембраны.
- Передача PS на внешнюю мембрану не является исключительной для апоптоза, но также может возникнуть при некрозе клеток.
- Ключевое отличие состоит в том, что клеточная мембрана остается нетронутой на ранних стадиях апоптоза, в то время как это скомпрометировано при раннем клеточном некрозе.
- Таким образом, Метод двойного окрашивания аннексина V и 7-AAD может быть использован для обнаружения раннего апоптоза клеток посредством проточной цитометрии.
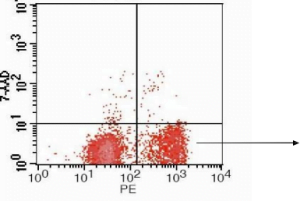
Проточный цитометрический анализ клеток Jurkat с использованием аннексина V-PE/7AAD после индуцирования апоптоза с цисплатином
Метод работы: (только для справки)
- Приготовление образцов клеток:
- Для прилипших клеток: Тщательно собрать среду для культивирования клеток в центрифужную трубку для более позднего переваривания клеток трипсином без ЭДТА. Когда ячейки могут быть осторожно пипетированы с помощью пипетки или наконечника пипетки, Добавить ранее собранное раствор клеточной культуры, Пипетка вниз по всем прилипшим ячейкам, и осторожно взорвать клетки. Снова заберите в центрифужную трубку. Центрифуга примерно 1000 об/мин для 5 Протокол для осадки клеток. Для конкретных клеток, Если клетки не могут быть полностью центрифугированы до дна центрифужной трубки, Вы можете надлежащим образом продлить центрифужное время или немного увеличить центробежную силу. Тщательно аспиратор супернатанта. Около 50 мкл культурной жидкости может остаться, чтобы избежать аспирации клеток. Добавьте около 1 мл из 4 ℃ PBS перед охлаждением, Восстановите клетки, снова центрифуга, чтобы опекаться клетками, и тщательно аспирировать супернатант;
- Для суспензийных ячеек: Центрифуга примерно 1000 об/мин для 5 Протокол для осадки клеток. Для конкретных клеток, Если клетки не могут быть полностью центрифугированы до дна центрифужной трубки, Вы можете надлежащим образом продлить центрифужное время или немного увеличить центробежную силу. Тщательно аспиратор около 50 мкл культурной жидкости, которая может остаться, чтобы избежать аспирации клеток. Добавьте около 1 мл из 4 ℃ PBS перед охлаждением, Восстановите клетки, снова центрифуга, чтобы опекаться клетками, и тщательно аспирировать супернатант;
- Разбавить буфер связывания 1:3с деионизированной водой (4ML 4X -связывающий буфер + 12Ml деионизированная вода);
- Резуспендируйте клетки с помощью 1x-связывающего буфера и отрегулируйте концентрацию до 1-5 × 106/мл;
- Возьмите 100 мкл клеточной суспензии в 5 мл проточной трубки, Добавить 5 мкл аннексина V/PE, чтобы хорошо перемешивать, и инкубировать для 5 минут при комнатной температуре в темноте;
- Добавить 10 мкл 20г/мл 7AAD и 400 мкл PBS для выполнения обнаружения потока
Экспериментальный дизайн:
-
Нетрансфицированные клетки
- Пустая трубка: Негативные контрольные клетки, Без аннексина V/PE, 7Очень сильно, используется для регулировки напряжения.
- Одиночная окрашивающая трубка: положительные контрольные клетки, Только с аннексином V/PE или только 7AAD для корректировки и компенсации.
- Обнаружение трубки: обработанные клетки, Добавить аннексин V/PE, 7Очень сильно. После регулировки компенсации напряжения с помощью пустой трубки и одной красильной трубки, требуемые данные о потоке можно получить.
-
Трансфекция с GFP
- Нетрансфицированная пустая трубка: Нетрансфицированные клетки, Без аннексина V/PE, 7Очень сильно, использовались для регулировки напряжения.
- Нетрансфицированная однократная трубка: Для нерансфицированных клеток с явным апоптозом, Добавьте только аннексин V/PE или только 7AAD для корректировки и компенсации.
- Трансфекция пустой трубки GFP: Трансфектные контрольные клетки GFP без аннексина V/PE, 7AAD для корректировки и компенсации.
- Обнаружение трубки: обработанные клетки, плюс аннексин V/PE, 7Очень сильно. После корректировки компенсации напряжения, Получите необходимые потоковые данные.
Меры предосторожности:
- Аннексинв совместим с фосфатидилсерином (Пса), и PS не имеет разницы между различными видами. В нормальных клетках, PS распределяется только на внутренней стороне липидного бислоя клеточной мембраны. На ранней стадии апоптоза, PS поворачивается от внутренней стороны липидной мембраны к внешней стороне.
- Переваривать с низким концентрацией трипсин, осторожно взорвать прилипшие клетки 2 к 3 раз, и центрифуга при 4 ° C 1000 об/мин для 5 минуты, Если обрабатываться должным образом, ущерб, вызванный трипсином, можно контролировать внутри 5%. Если есть контрольная группа, Экспериментальные результаты не приведут к значительным
- Добавьте PI первым. Мало того, что трудно судить, является ли окрашивание равномерным и достаточным для каждой группы, Но сам PI также токсичен для клеток и окажет большее влияние на экспериментальные результаты, чем панкреатин. Это не рекомендуется.
- Аннексинв является Ca-зависимым белком, Таким образом, ЭДТА не может быть добавлена, чтобы предотвратить хелатирование ЭДТА и, таким образом, влиять на аннексин V, тем самым влияет на
- При использовании проточной цитометрии для обнаружения апоптоза, 7AAD сильно зависит от времени. Потому что 7AAD маркируется, это увеличит цитотоксичность. Со временем, это увеличит окрашивание 7AAD, особенно при обнаружении раннего апоптоза. В дополнение к увеличению зазора между популяциями клеток на проточном цитометре, ошибка значительно увеличится. В целом, 7AAD добавлен и машина сразу же на машине, и тогда тест завершен в рамках обоих методов в порядке, Но ошибка, вызванная выполнением наших рабочих этапов, будет меньше.
Связанная литература:
[1] Руфенг Чжао, Цзин Джин, Синью Солнце, и другие. Создание клонально полученной куриной эмбриональной фибробластской линии клеток фибробластов (CSC) с высокой эффективностью трансфекции и способностями в качестве фидерной ячейки. Журнал сотовой биохимии. Август 2018. (ЕСЛИ 2.959)



Отзывы
Отзывов пока нет.