사양
Taq DNA 중합효소 1000 U(혼합 버퍼 포함) (아이스백과 함께 배송)
저장 정황:
Taq DNA 중합효소 및 Taq PCR 키트는 다음 장소에 보관해야 합니다. -30 수령 후 항온 냉동고에서 -15°C까지.
시험:
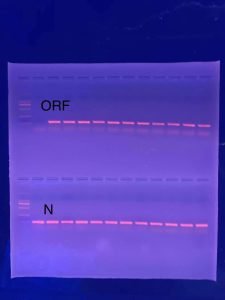
시작하기 전 주의사항:
- Gel-loading 시약과 Gel-tracking 염료가 포함된 Load PCR Buffer 제공.
- PCR 버퍼 및 로드 PCR 버퍼는 다음의 최종 농도를 산출합니다. 1.5 반응 혼합물의 mM MgCl2. 필요한 경우 추가하여 Mg2+ 농도를 조정합니다. 25 mM MgCl2.
- 고품질 PCR 등급 dNTP Mix (10 mm) 필요한 경우 별도로 사용 가능.
- 열 순환기에 배치될 때까지 PCR 튜브를 얼음 위에 보관하십시오..
- 템플릿 컨트롤 없음 포함 (NTC) 모든 분석에서.
준비 그리고 믹싱:
- 완충액과 시약을 실온이나 얼음 위에서 해동하세요., 완전히 해동한 후 얼음 위에 보관하세요.
- 템플릿 DNA를 제외한 모든 PCR 구성 요소가 포함된 반응 혼합물을 준비합니다.. 준비하다 10% 필요 이상으로 많은 양.
- 반응 혼합물을 철저히 혼합하고 PCR 튜브에 분주합니다..
- 템플릿 DNA 추가 (1μg/반응) PCR 튜브에. RT-PCR의 경우, 역전사효소 반응에서 분취량 추가, 초과하지 않음 10% 최종 PCR 볼륨의.
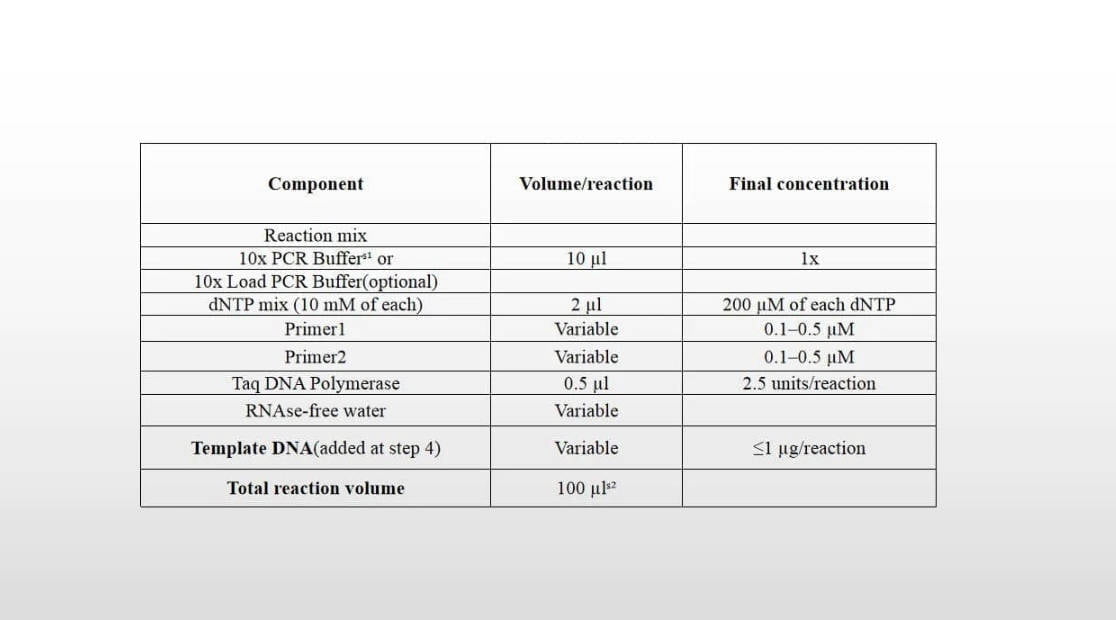
SENO Taq DNA Polymerase를 사용한 반응 설정
| 요소 | 부피/반응 | 최종 농도 |
| 반응 혼합 | ||
| 10x PCR 버퍼ˢ¹ 또는 | 10 μl | 1엑스 |
| 10x PCR 버퍼 로드(선택 과목) | ||
| dNTP 믹스 (10 각각의 mM) | 2 μl | 200 각 dNTP의 µM |
| 실시예 1 | 변하기 쉬운 | 0.1-0.5μM |
| 퍼스트2 | 변하기 쉬운 | 0.1-0.5μM |
| Taq DNA 중합효소 | 0.5 μl | 2.5 단위/반응 |
| RNAse가 없는 물 | 변하기 쉬운 | |
| 템플릿 DNA (단계에서 추가됨 4) | 변하기 쉬운 | 1μg/반응 |
| 총 반응량 | 100 µlˢ² |
열의 사이클링:
제조업체의 지침에 따라 열 순환기 프로그래밍. 제공된 사이클링 프로그램을 참조하세요..
Taq DNA Polymerase에 최적화된 사이클링 조건
| 단계 | 시간 | 온도 | 논평 |
|---|---|---|---|
| 초기 변성 | 3 분 | 94℃ | |
| 3-스텝 사이클링: | |||
| 변성 | 0.5-1 분 | 94℃ | |
| 가열 냉각 | 0.5-1 분 | 50–68°C | 프라이머의 Tm보다 약 5°C 낮음. |
| 확대 | 1 분 | 72℃ | 다음보다 긴 PCR 제품의 경우 1 kb, 대략적인 연장 시간을 사용하십시오. 1 kb당 분 DNA. |
| 사이클 수 | 25-35 | ||
| 최종 연장 | 10 분 | 72℃ |
쉽게 한 핫 스타트:
PCR 프로그램 시작. 열 순환 장치가 94°C에 도달하면, 특이성 향상을 위해 PCR 튜브를 사이클러에 배치.
PCR 후:
- 증폭 후, 시료는 밤새 2~8°C에서 보관하거나 장기간 보관하려면 -20°C에서 보관할 수 있습니다..
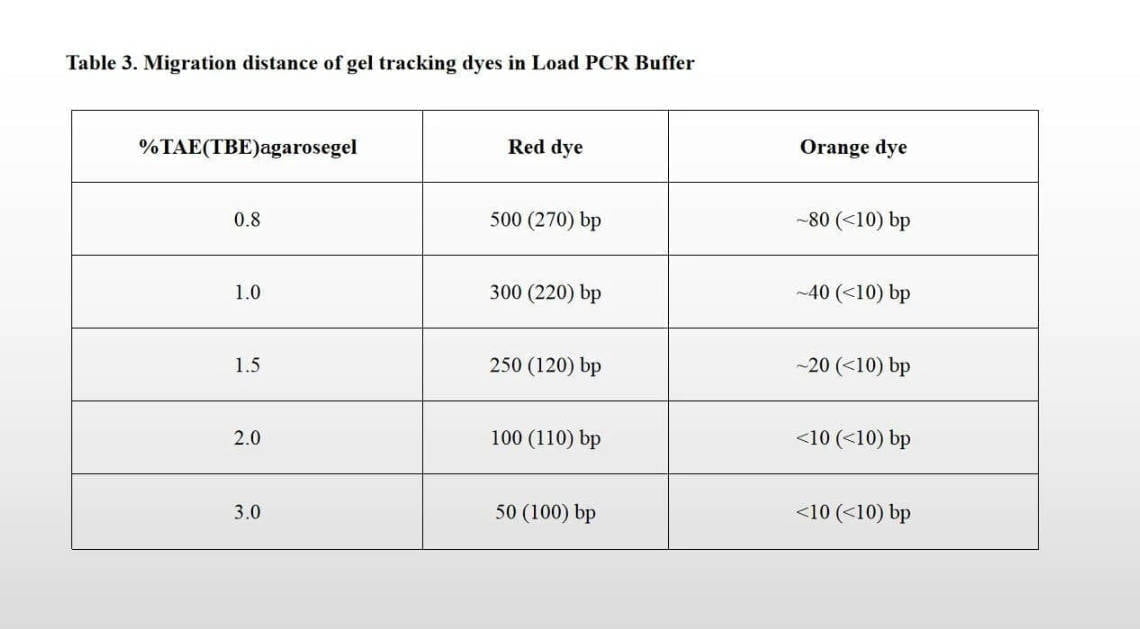
- 로딩 버퍼 및 겔 추적 염료를 사전에 추가하지 않고도 Load PCR Buffer를 사용하여 PCR 산물을 아가로스 겔에 직접 로딩할 수 있습니다.. 이동 거리 및 젤 추적 염료는 제공된 표를 참조하세요..
Load PCR Buffer에서 젤 추적 염료의 이동 거리
| % 태 (TBE) ㅏ가로스 젤라틴 | 빨간색 염료 | 주황색 염료 |
| 0.8 | 500 (270) bp | ~80 (<10) bp |
| 1.0 | 300 (220) bp | ~40 (<10) bp |
| 1.5 | 250 (120) bp | ~20 (<10) bp |
| 2.0 | 100 (110) bp | <10 (<10) bp |
| 3.0 | 50 (100) bp | <10 (<10) bp |










상품평
아직 상품평이 없습니다.