- 試薬キットのコンポーネント
| 仕様 | 50T | 100T |
| 猫. いいえ. | SN0201 | SN0202 |
| DNA抽出カラム (セット) | 50 (セット) | 100 (セット) |
| 試薬バッファー溶液a | 30 ミリリットル | 2 × 30 ミリリットル |
| 試薬バッファー溶液c | 30 ミリリットル | 2 × 30 ミリリットル |
| 洗浄バッファー 1 | 15 ミリリットル | 2 × 15 ミリリットル |
| RNase A | 1ミリリットル | 1ミリリットル |
| 溶出バッファー | 20 ミリリットル | 20 ミリリットル |
| 取扱説明書 | 1 | 1 |
- ストレージ
このキットは室温で保存する必要があります (15-25℃) 乾燥した状態で、保存できます 12 月. DNA抽出精製カラムは、までのためにクールで乾燥した環境に保存できます 1 年. RNaseAには防腐剤が含まれており、室温で輸送できます, しかし、長期保管の場合, -20℃に保持する必要があります.
- 試薬キットを使用するための指示
3.1 このキットは分子生物学の研究目的を目的としており、疾患の診断や治療に使用すべきではありません.
3.2 キットの一部のコンポーネントには刺激物が含まれています; 必要な予防策を講じることをお勧めします (保護服やゴーグルを着用するなど).
3.3 このキットを使用するには、高速遠心分離機などの追加の機器が必要です, 水浴 (メタルバス), 渦ミキサー, 無水エタノール, 液体窒素, クロロホルム, 滅菌脱イオン水, およびEPチューブ.
- 試薬キットの紹介
The CTAB-ベースの植物 DNA精製 キットは、DNAを精製するための改善されたCTABメソッドを提供します, 効率的にDNAを沈殿させる特定の結合バッファーを利用します, その後、吸着カラムを介して高純度DNAを収集します.
このキットは、植物組織や菌類に広く使用されています, 内部のサンプルから総DNAを抽出できる 2 時間 (ミトコンドリアDNAおよび葉緑体DNAを含む). 抽出されたDNAは、次のような下流の実験に直接使用できます PCR, サザンブロット, その他.
- 実験原則と手順
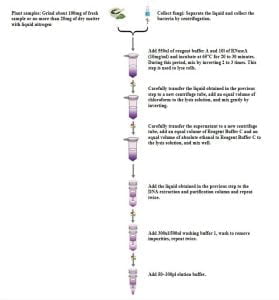
- 抽出プロセス
実験を開始する前の注意事項:
- 試薬バッファーAとc 低温条件下で沈殿する可能性があります. 65°Cで加熱することをお勧めします 5 沈殿物が溶解した後に数分と使用.
- ウォッシュバッファ 1 ボトルラベルに示されているように、特定の量の無水エタノールを追加する必要があります. エタノールが追加されたら、ラベルにマークを付けます.
- 溶出バッファーはaです 0.1X TEソリューション最小限のEDTAを含む. EDTAがその後の実験に影響を与える場合, 溶出緩衝液の代替として滅菌脱イオン水が推奨されます.
- サンプル処理:
- マテリアルコレクションとストレージ:
収集したばかりの素材, すぐに使用しない場合, 液体窒素に入れ、最終的に-80°Cで保存する必要があります. 乾燥材料は室温で保管できます.
- もし可能なら, より少ない多糖類とポリフェノールが含まれているため、新鮮な材料を収集します.
- 液体培養から菌を集めるとき, 遠心分離によって液体を分離し、真菌の体を集めます.
- 周りを挽く 100 新鮮なサンプルのmgまたはそれ以上 20 液体窒素を使用した乾燥材料のmg.
(注記: サンプル量が異なる場合がありますが、使用する前に予備実験を通じて最適化が必要になる場合があります.)
- 追加 550 μLの試薬バッファーAおよび 10 μLのRNase a (10 mg/ml) 接地サンプルに組織の塊がないことを確認するために. 組織の塊は溶解するのが難しく、DNAの収率を減らすことができます. 混ぜないでください 試薬バッファーAおよびRNase A使用前に.
- 65°Cでインキュベートします 20-30 分, 穏やかに反転します 2-3 回. このステップは、細胞溶解のためです.
- 溶解物の遠心 5 数分 14,000 RPM (20,000×g).
(注記: 一部の植物材料は、このステップで多くの粘着性物質を持っているかもしれません, 後続のステップでDNAをせん断することができます. 理想的には, 遠心分離後に上清を新しい遠心管に移してこれらの物質を除去します.)
- 前のステップで得られた液体を慎重に新しい遠心分離機チューブに移します.
(注記: 約 500 μLの液体を伝達できます; いくつかの種の場合, それよりも少ないかもしれません 500 μl.)
- 等量のクロロホルムを溶解物に追加し、そっと混合します.
(注記: 例えば, 追加 500 あなたが持っている場合、μLのクロロホルム 500 lysateのμl. 溶解物の体積が少ない場合 500 μl, それに応じてクロロホルムの体積を調整します.)
- で遠心分離します。 12,000 の回転数 10 分.
- 上清を新しい遠心管に慎重に移します (約 500 μl).
- 等量を追加します 試薬バッファーc 溶解物に等量の無水エタノール, ミックスします.
(例えば, 追加する場合 450 試薬バッファーc, それから追加します 450 無水エタノールのμL. 溶解物の体積が少ない場合 450 μl, 試薬バッファーCの量を比例して減らします. 試薬バッファーcを追加すると、いくらかの降水量が発生します, しかし、それは後続の実験に影響しません.)
- 得られた液体をDNA精製カラムに移します (キット), 約 650-700 毎回μL. オーバーでの遠心 8,000 の回転数 1 分, 収集された廃棄物を廃棄します, 次のステップのために、コレクションチューブを精製列に再挿入します.
- ステップを繰り返します 11, 残りの液体をDNA精製カラムに追加します (キット) そして、オーバーで遠心分離します 8,000 の回転数 1 分. 廃棄物とコレクションチューブを捨てます.
- DNA精製列を配置します (キット) 新しいコレクションチューブに, 追加 300 μlの ウォッシュ バッファ 1, オーバーでの遠心 8,000 の回転数 1 分, 廃棄物を捨てます, DNA精製カラムを再挿入します (キット) 次のステップのためにチューブに.
(注記: 無水エタノールが追加されていることを確認してください ウォッシュ バッファ 1.)
- 追加 500 rinseバッファーのμl 1 DNA精製列に (キット), で遠心分離する 14,000 RPM (20,000×g) のために 2 分, 乾燥膜の遠心分離時間をわずかに延長します.
- DNA精製列を配置します (キット) 新しい遠心チューブに, 開ける, 65°Cで加熱します 2 分. このステップは、残留エタノールが下流の実験に影響を与えるのを防ぐために、可能な限りエタノールを蒸発させるために延長される可能性があります.
- 滴下 100 μLの溶出緩衝液膜に, で遠心分離する 12,000 の回転数 2 分.
(注記: 1. DNAを溶出します 50 μL溶出バッファーはDNA濃度を増加させる可能性がありますが、総DNA収量を減少させる可能性があります. 2. 溶出物は、2回目の溶出のためにDNA精製カラムに再適用することができます, で遠心分離する 12,000 の回転数 2 収集する議事録, これにより、DNA収量が改善される可能性があります.)












レビュー
まだレビューはありません.