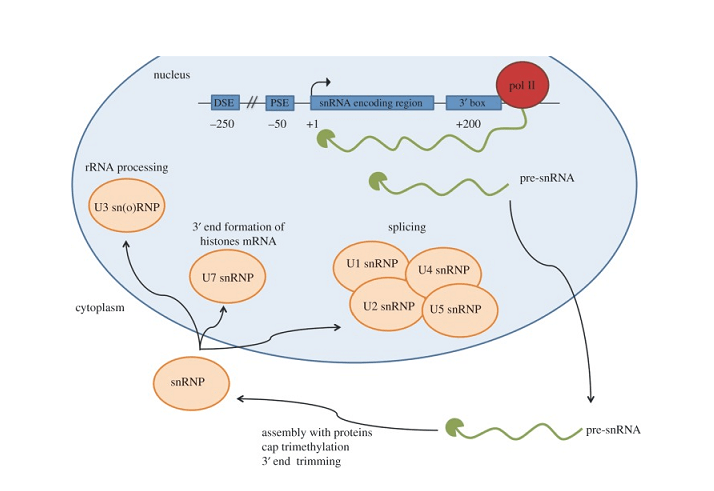
単一核RNA, またはsnRNA, 短い長さにもかかわらず、細胞内で重要な役割を果たします. 核内のみに存在する非コーディング RNA 分子として, snRNA は、機能的なタンパク質の合成を助ける重要な転写後修飾に関与します。. snRNA には 2 つの主要なクラスがあります – U1, U2, U4, U5, 核内小型リボ核タンパク質を形成する U6 (snRNP) スプライシングに関与する, 他の RNA の化学修飾をガイドする H/ACA および C/D ボックス snoRNA.
単核 RNA シーケンシングとは (snRNA配列)?
単核 RNA シーケンス, またはsnRNA配列, 個々の細胞から単離された核トランスクリプトームを解析する革新的な技術です。. このアプローチは、解離中に結果を歪める可能性がある転写ストレス応答を最小限に抑えるのに役立ちます. 従来の単一細胞 RNA シーケンスとの比較 (scRNA配列), snRNA-seq は、細胞の不均一性を調査する際の有用性を高める特定の利点を示します。.
snRNA-seqとscRNA-seqの違いは何ですか?
単核 RNA シーケンス (snRNA配列), snRNA-seq または sNuc-seq とも呼ばれます, 単離が困難な細胞における遺伝子発現をプロファイリングするために使用される革新的な RNA シーケンス手法です。. この技術は、単一細胞 RNA シーケンスの強力な代替手段として機能します。 (scRNA配列) 無傷の細胞の代わりに核を分析することによって. しかし、snRNA-seq と scRNA-seq の正確な違いは何でしょうか。? 主な違いを詳しく見てみましょう.
scRNA-seq は細胞質と核の両方の転写物を測定します, 細胞の遺伝子発現プロファイルの包括的なビューを提供します. 対照的に, snRNA-seq は主に核転写物を測定します, 核自体内の RNA の分析に焦点を当てているため. この標的を絞ったアプローチにより、偽の遺伝子発現の発生が最小限に抑えられます。, 成熟したリボソームが細胞質に存在するため、. したがって, 解離プロセス後に発現される転写因子は翻訳されません, 下流の標的の転写を阻止する.
snRNA-seq は困難な組織タイプにどのように対応するか?
一つには, snRNA-seq は、単一細胞に完全に解離することが難しい、より多様な組織タイプに対応します。. 脳のような高密度の細胞外マトリックスを含む複雑な組織, 腎臓, snRNA-seq を使用すると、より穏やかな解離プロトコルにより心臓をより効果的に分析できます。. これにより、転写変化を受ける可能性がある、または scRNA-seq に必要なより厳しい解離中に分解する可能性がある、敏感な細胞タイプの完全性が維持されます。.
アーカイブされたサンプルに snRNA-seq を使用する利点は何ですか?
SnRNA-seq は、アーカイブされた臨床サンプルの研究もサポートします. 無傷の核が単離できる限り、scRNA-seq と適合しない凍結組織または固定組織のプロファイリングが可能. これにより、新たに単離された単一細胞を必要とする他のシーケンス手法と比較して、可能な研究応用の範囲が拡大します。. 特に, snRNA-seq により、研究者は死後のヒトの脳組織を分析して、単一細胞レベルで神経細胞の多様性を明らかにできるようになりました.
snRNA-seq が提供する独自の視点とは?
完全なトランスクリプトームの包括的なビューではなく, snRNA-seq は、snRNA によって調節される核プロセスと相互作用についての焦点を絞った洞察を提供します. 限られた核空間内の制御機構について、独自に拡大された視点を提供します。. snRNA-seq を複雑な組織サンプルに適用すると、scRNA-seq のみでは検出されない可能性のある新しい細胞の種類と状態が明らかになりました. このような発見により、細胞の組織化と特殊化についての理解が深まります。, 精密医療のフロンティアを拡大する.
snRNA-seq は、困難なサンプルにおける遺伝子発現のプロファイリングにどのように役立ちますか?
snRNA-seq の核プロファイリング機能は、従来の scRNA-seq アプローチを使用して分析するのが難しいサンプルにとって特に価値があることがわかります。. 特定の組織タイプでは、高密度のマトリックス組成などの性質により技術的な困難が生じます。, 解離時の脆弱性, または単一細胞の単離に必要な酵素処理との不適合. 固定によって保存されたアーカイブサンプルにも課題がある.
哺乳動物の心臓組織の研究にsnRNA-seqがどのように使用されたか?
哺乳類の心臓組織は、scRNA-seq には扱いにくいが、snRNA-seq 解析には適したシステムの例となる. 心筋細胞は、細胞損傷がなければ簡単に破壊されない複雑な相互接続ネットワークを形成しています. しかし, で 2020 ドイツの研究者がsnRNA-seqを使用して初めて成体哺乳類の心臓の配列決定に成功. 心筋細胞全体ではなく核を単離することにより, 彼らは、心筋内の特徴的な細胞集団の実際的な分布を取得しました。. このような大規模なプロファイリングは、scRNA-seq 手法では非現実的です。.
snRNA-seq は神経細胞集団の研究にどのようなメリットをもたらしますか?
ニューロン集団は、snRNA-seq 機能の恩恵を受ける別のクラスを代表します。. 脳は複雑に配線されたニューロンで構成されており、完全な単一細胞としては容易には解離されません。. そうしようとするとストレス反応が誘発され、結果が歪む可能性があります. しかし、神経サブタイプのトランスクリプトームの不均一性を研究することは、神経生物学の理解を深めます。, 病気のメカニズム, などなど. CNS組織用に最適化されたSnRNA-seqプロトコルは、アーカイブされたヒト脳サンプルと新たに切除されたヒト脳サンプルの両方を単一細胞解像度で保存します。.
snRNA-seq はどのようにして凍結臨床サンプルの分析を可能にするのか?
凍結臨床サンプルも同様に、snRNA-seq によって克服される限界を引き起こします. snRNA-seq によって検出された健康な肺核と線維化した肺核を比較した肝疾患研究により、構成細胞タイプの公平な同定が明らかになりました. アーカイブされた患者生体標本のこのような分析は、scRNA-seq 入力の制約により以前は分析から除外されていました。. 研究者は、精密な診断と治療に影響を与える幅広い現実世界のサンプルに「オミクスの洞察」を適用できるようになりました。.
snRNA-seq プロトコルは転写の乱れをどのように最小限に抑えますか?
snRNA-seq の主な利点は、熱によって生じる技術的問題を未然に防ぐ、より穏やかな解離プロトコルにあります。, 長時間のインキュベーション時間または過剰な酵素処理. 概要, 核分離に採用された穏やかな溶解法により、scRNA-seq 結果を歪める可能性があるストレス誘発性の転写変化が防止されます。. 無傷の細胞を過酷な解離ステップにさらすことなく, snRNA-seq サンプリングは、解離時に存在する転写物の完全性をよりよく保存します.
snRNA-seq はどのようにして偽の遺伝子発現パターンを最小限に抑えるのか?
これにより、解離プロセス自体によって引き起こされる偽の遺伝子発現パターンの発生が最小限に抑えられます。. 成熟リボソームが細胞質コンパートメント内のみに存在するということは、解離後に発現される初期ストレス応答遺伝子をコードする mRNA は翻訳できないことを意味します. したがって、その下流の転写標的は変化しないままです。. 両方の技術を同じ組織に適用した比較研究により、snRNA-seq は解離誘発性の転写摂動が少なく、より幅広い細胞タイプのサブセットを捕捉できることが示されました。.
短い溶解時間は snRNA-seq のトランスクリプトーム バイアスの制御にどのように役立ちますか?
短い溶解時間などの追加要素は、トランスクリプトームのバイアスの制御に役立ちます. 単核ライブラリーの調製に進む前に氷上に長時間放置すると、転写変化が開始され、データ品質に悪影響を及ぼす可能性があります。. 慎重なタイミングでそのような影響を軽減します. 十分な初期組織量により、方法論上の制限を考慮した堅牢なプロファイリングに必要な高品質の核調製も保証されます。.
最適化された snRNA-seq ワークフローは技術的なアーティファクトをどのように最小限に抑えるか?
全体, 最適化された snRNA-seq ワークフローにより、生物学的解釈を複雑にする分析前要因を最小限に抑えます. 核内容物の穏やかな抽出により、内因性の生物学的プロセスよりも技術的アーチファクトによって形成された遺伝子発現プロファイルが示されます。. これにより、規制ネットワークに関して収集された発見がより明確になり、信頼性が高まります。, まれな部分集団, 複雑な生体内システム内の細胞特化プログラム.
研究者は生物学的理解を進めるためにsnRNA-seqをどのように適用できるか?
細胞の複雑さに関する私たちの見方を洗練する革新的な技術として, snRNA-seq は多様な研究用途に新たな境地を切り開きます. いくつかの例は、科学の進歩を促進するその可能性を強調しています:
- 発生生物学: 異なる胚段階の核を比較すると、分化を導く段階固有の制御プログラムが明らかになる可能性がある. 空間的に分解されたsnRNA-seqマッピングの発生勾配はパターン形成メカニズムを明らかにする可能性がある.
- 病気の病理学: 病気の組織核と健康な組織の核をプロファイリングすることで、まれな細胞タイプの病理学に関連した変化を特定し、病気のメカニズムを解明できる可能性がある. 患者サンプルの分析により、正確な診断と治療法が得られる可能性がある.
- 神経精神医学: snRNA-seq を介してアーカイブされた死後脳組織を調査することは、精神疾患の神経多様性を特徴付けるのに役立ちます. 長期的な研究により、長期的なバイオマーカーと治療標的が明らかになる可能性がある.
- 進化学: SnRNA-seq により、組織特性の生物間の違いにより以前は困難であった種間の比較が実現可能になります. そのような “phylo-snRNA-seq” 保存された規制プロセスと多様な規制プロセスについての私たちの理解を知らせる.
- マルチオミックス統合: snRNA-seq と空間プロファイリング技術を組み合わせることで、核微小環境を解明する空間的に分解されたエピゲノムおよびトランスクリプトーム マップが得られます。. 空間転写データをプロテオミクス層またはメタボロミクス層と統合することで、システムレベルのコンテキストが提供されます.
まとめ
単一細胞分析に革命をもたらすいくつかの新しい技術の 1 つとして, snRNA-seq は、以前は扱いにくかったサンプルを実験的に扱いやすくすることで発見を促進します. 核オミクスのスケールアップは、再生医療から精密腫瘍学まで多様な分野を前進させる新たな洞察を約束します. 補完的なアプローチと併せて, snRNA-seq は、生命の魅惑的な複雑さを前例のないレベルで解明するのに役立ちます.