| Attribut | Détails |
|---|---|
| Chat | G1340 |
| Taille | 7 x 50 ml / 7 x 100 ml |
| Stockage | RT, éviter la lumière, valable 1 année |
Composants du kit
| Réactif | Volume | Stockage |
|---|---|---|
| Réactif (UN): | ||
| Solution d'hématoxyline de fer de Weigert | 25ml (A1) / 50ml (A2) | RT, éviter la lumière |
| Réactif (B): | ||
| Solution de différenciation acide-alcool | 50ml | RT |
| Réactif (C): | ||
| Solution de bleuissement | 50ml | RT |
| Réactif (D): | ||
| Solution de fuchsine acide Ponceau | 50ml | RT, éviter la lumière |
| Réactif (E): | ||
| Solution d'acide acétique | 50ml | RT |
| Réactif (F): | ||
| Solution d'acide phosphomolybdique | 50ml | RT, éviter la lumière |
| Réactif (g): | ||
| Solution de bleu d'aniline | 50ml (F1) / 100ml (F2) | RT, éviter la lumière |
Introduction
Le Masson Trichrome Stain Kit est conçu pour l’étude du tissu conjonctif, muscle, et fibres de collagène. Il aide à distinguer le collagène du muscle lisse, qui peut paraître similaire au microscope. Les noyaux sont colorés à l’hématoxyline de fer de Weigert, et le cytoplasme et les muscles sont ensuite colorés avec du fuchsia acide écarlate Beibrich. Après traitement aux acides phosphotungstique et phosphomolybdique, le collagène est mis en évidence par coloration au bleu d'aniline. Le rinçage à l'acide acétique après coloration rend les couleurs plus délicates et transparentes.. Ce kit convient pour une utilisation sur des surfaces fixées au formol, inclus en paraffine, ou coupes congelées.
Protocoles (Pour référence seulement)
- Déparaffiner à l'eau distillée.
- Colorer avec la solution d’hématoxyline de fer de Weigert pour 5-10 minutes.
- Différencier avec une solution de différenciation acide-alcool pour 10-15 secondes.
- Bleu dans la solution de bleuissement pour 2-5 minutes. Rincer à l'eau déminéralisée.
- Colorer avec la solution Ponceau-Acid Fuchsia pour 5-10 minutes. Rincer à l'eau déminéralisée.
- Différencier en solution d'acide phosphomolybdique pour 1-2 minutes ou jusqu'à ce que le collagène ne soit plus rouge.
- Sans rinçage, ajoutez la solution de bleu d'aniline à la section et colorez pendant 1-2 minutes.
- Placer la section dans la solution de travail d’acide acétique (Mélanger 1 une partie de solution d'acide acétique et 2 pièces d'eau déminéralisée) pour 1 minute.
- Se déshydrater rapidement 95% éthanol, éthanol absolu, et transparent au xylène.
- Sceller avec du résinène.
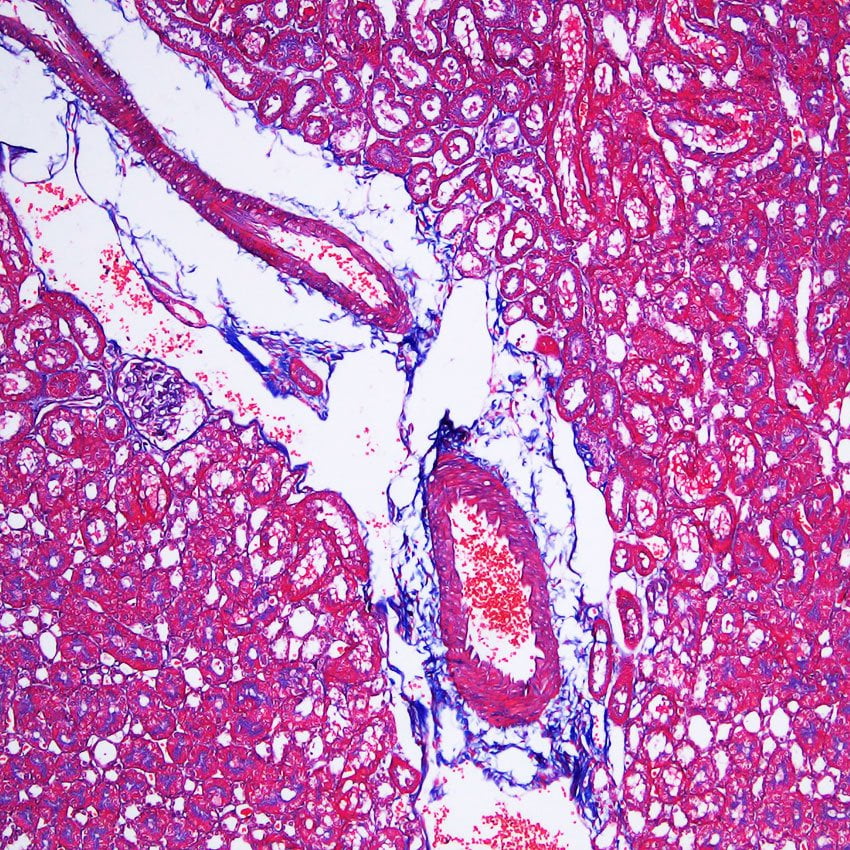
Résultat
- Noyau: Noir
- Cytoplasme, Fibres musculaires: Rouge
- Collagène: Bleu
Note
- Le décirage des tranches doit être aussi propre que possible.
- Des quantités égales de A1 et A2 sont mélangées pour former une solution de coloration à l'hématoxyline de fer Weigert., perdant généralement sa capacité de teinture au sein 24 heures.
- La fixation des tissus joue un rôle important. Différents fixateurs peuvent prolonger ou raccourcir le temps de coloration.
- En coloration trichromatique Masson classique, L'hématoxyline de Harris a été utilisée pour la coloration nucléaire, mais l'hématoxyline Weigert est utilisée dans cette solution de coloration pour obtenir des couleurs plus vives.
- Le temps de différenciation de l'éthanol acide doit être déterminé en fonction de l'épaisseur de la tranche, type de tissu, et l'âge.
- Une solution acide faible peut améliorer la clarté et la luminosité des couleurs.
- La différenciation de l'acide phosphomolybdique doit être contrôlée au microscope jusqu'à ce que les fibres de collagène soient rouge clair.
- La solution de bleuissement Masson peut être remplacée par la solution de bleuissement Scott ou 0.1-1% solution de carbonate de lithium.

Commentaires
Il n'y a pas encore de critiques.