| Attribut | Détails |
|---|---|
| Chat | G1480 |
| Taille | 4 x 2 ml, 4 x 10 ml, 4 x 20 ml |
| Stockage | -20°C, éviter la lumière, valable 6 mois |
Composants du kit:
| Réactif | 4x2mL | 4x10mL | 4x20mL | Stockage |
|---|---|---|---|---|
| Réactif a: Fixateur ALP | 2ml | 10ml | 20ml | RT, éviter la lumière |
| Réactif B: Solution d'incubation ALP | B1: Solution AS-BI 1 ml | 5ml | 10ml | -20°C, éviter la lumière |
| B2: Solution FBB 1 ml | 5ml | 10ml | -20°C, éviter la lumière | |
| Réactif C: Solution nucléaire rapide rouge | 2ml | 10ml | 20ml | 2-8°C, éviter la lumière |
| Réactif D: Solution de vert de méthyle | 2ml | 10ml | 20ml | RT, éviter la lumière |
Introduction:
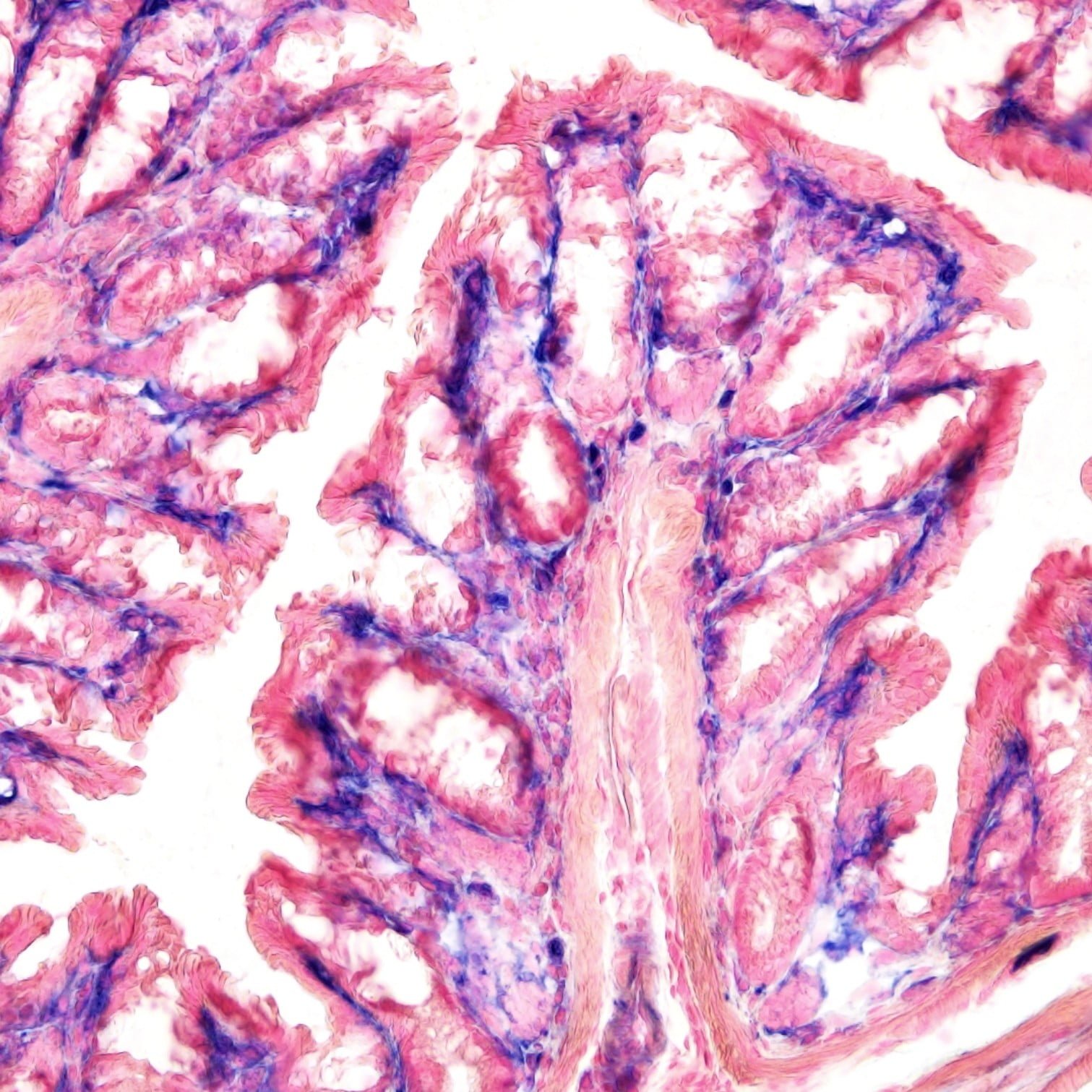
Phosphatase alcaline (ALP ou AKP) est largement distribué dans les tissus des mammifères, principalement au niveau des sites d'échange de substances actives comme les membranes cellulaires, réticulum endoplasmique, Complexe de Golgi, lysosomes, granules de neutrophiles, et les membranes des cellules musculaires lisses. Le kit de coloration ALP (Méthode Kaplow) utilise une méthode de couplage azoïque pour démontrer l'activité ALP, fournissant des résultats fiables par rapport aux méthodes de précipitation de sels métalliques.
Matériel auto-fourni:
Lame de verre, Boîte humide, Microscope optique
Protocole (pour référence seulement):
Pour frottis ou taches de coupe:
- Corrigez les frottis ou les sections avec ALP Fixative pendant 3 minutes, puis laver à l'eau distillée.
- Appliquer la solution d'incubation ALP, incuber dans une boîte humide dans l'obscurité pendant 15 à 20 minutes, puis laver à l'eau distillée.
- Recolorer avec une solution de rouge rapide nucléaire ou une solution de vert de méthyle pendant 3 à 5 minutes..
- Visualiser les coupes au microscope après lavage ou scellement avec de la gélatine glycérol.
Pour les taches de cellules adhérentes:
- Rincer les cellules cultivées avec du PBS, puis réparez-les avec ALP Fixative ou 4% PFA, suivi d'un lavage au PBS.
- Appliquer la solution d'incubation ALP, incuber dans une boîte humide dans l'obscurité pendant 15 à 20 minutes, puis laver avec du PBS.
- Recolorer avec une solution de rouge rapide nucléaire ou une solution de vert de méthyle pendant 3 à 5 minutes..
- Laver avec du PBS et visualiser les coupes au microscope.
Résultat:
| Résultat | Couleur |
|---|---|
| Site positif de l'ALP | Bleu |
| Noyau | Rouge ou Vert |
Critères d'évaluation des frottis de sang et de moelle osseuse:
| Niveau positif | Caractéristiques de teinture |
|---|---|
| 0 | Ne pas granuler |
| 1 | Légèrement granulé |
| 2 | Granule de qualité moyenne |
| 3 | Granule majoritaire |
| 4 | Granule complet |
Note:
- Utilisez des échantillons frais et corrigez les coupes rapidement pour préserver l’activité enzymatique.
- Manipulez doucement les cellules cultivées pendant la coloration pour éviter tout dommage ou perte..
- La solution d’incubation ALP peut perdre rapidement son efficacité, utiliser rapidement.
- Recolorer avec une solution de rouge rapide nucléaire ou une solution de vert de méthyle.
- Inclure un contrôle positif pour chaque échantillon.
Référence:
Yu Jiang, Dantien Zhu, Liu Wenfeng, et autres. L'inhibition de la voie Hedgehog provoque une atrésie folliculaire primaire et diminue la capacité de prolifération des cellules souches germinales femelles ou leur caractère souche.. Recherche sur les cellules souches & Thérapie. Juillet 2019. (SI 4.627)


Commentaires
Il n'y a pas encore de critiques.