Kit zur Bestimmung des Stärkegehalts
Notiz: Nehmen Sie vor dem Test zwei oder drei verschiedene Proben zur Vorhersage. Betriebsausrüstung: Spektrophotometer/Mikroplatten-Reader.
Katze nein: BC0705
Größe: 100T/96S
Komponenten:
Reagenz I: 110 ml×1. Lagerung bei 4℃.
Reagenz II: 110 ml×1. Lagerung bei 4℃.
Reagenz III: Pulver×2. Lagerung bei 4℃.
Standard: Pulver×1, 10 mg Glukose (wasserfrei). Lagerung bei 4℃.
Standardlösung: Aufgelöst mit 1 ml destilliertes Wasser auf 10 mg/ml Glucose-Standardlösung, wenn die Standardlösung verwendet wird. Es kann für gespeichert werden 2 Wochen bei 4℃.
Funktionierende Lösung: Hinzufügen 2.625 ml destilliertes Wasser zu Reagenz III hinzufügen, langsam hinzufügen 14.875 ml konzentriertes H2SO4, Ständig umrühren und vor Gebrauch vollständig auflösen. Es kann für gespeichert werden 1 Woche bei 4℃.
Produktbeschreibung:
Stärke ist die Hauptspeicherform von Zucker in Pflanzen. Die Bestimmung des Stärkegehalts hat große Bedeutung bei der Beurteilung des Nährwerts von Lebensmitteln und der Erforschung des Zuckerstoffwechsels in Pflanzen.
Trennen Sie löslichen Zucker von Stärke, indem Sie 80% Ethanol, Anschließend wird die Stärke durch saure Hydrolyse in Glucose zersetzt. Der Stärkegehalt kann durch Messung des Glukosegehalts mithilfe einer kolorimetrischen Anthrone-Methode berechnet werden.
Erforderliche, aber nicht bereitgestellte Reagenzien und Ausrüstung:
Spektrophotometer/Mikroplatten-Reader, Wasserbad, verstellbare Pipette, Mikroglasküvette/96-Well-Platte mit flachem Boden, Mörtel/Homogenisator, Eis, konzentriertes H2SO4 und destilliertes Wasser.
Verfahren:
ICH. Probenvorbereitung:
-
- Nehmen 5 mg Probe, Im Mörser zermahlen und hinzufügen 1 ml Reagenz I. Nach der Homogenisierung, in ein Zentrifugenröhrchen überführen, in ein Wasserbad bei 80℃ stellen 30 Protokoll, dann bei Raumtemperatur zentrifugieren und 3000 ×g für 5 Protokoll, Den Überstand verwerfen, Niederschlag zurückhalten.
- Hinzufügen 0.5 Geben Sie ml destilliertes Wasser zum Niederschlag. Ins kochende Wasserbad stellen 15 Protokoll (Ziehen Sie den Deckel fest, um Wasserverlust zu vermeiden)
- Nach dem Abkühlen, hinzufügen 1 ml Reagenz II, 15 Min. ins kochende Wasserbad stellen, 3–5 Mal schütteln
- Nach dem Abkühlen, bei Raumtemperatur zentrifugieren und 3000 ×g für 15 Protokoll, Nehmen Sie den Überstand zum Test.
II. Bestimmung Verfahren:
- Heizen Sie das Spektrophotometer/Mikroplatten-Lesegerät vor 30 Protokoll, Wellenlänge anpassen 620 nm, Mit destilliertem Wasser auf Null stellen.
- Stellen Sie das Wasserbad auf 95°C ein.
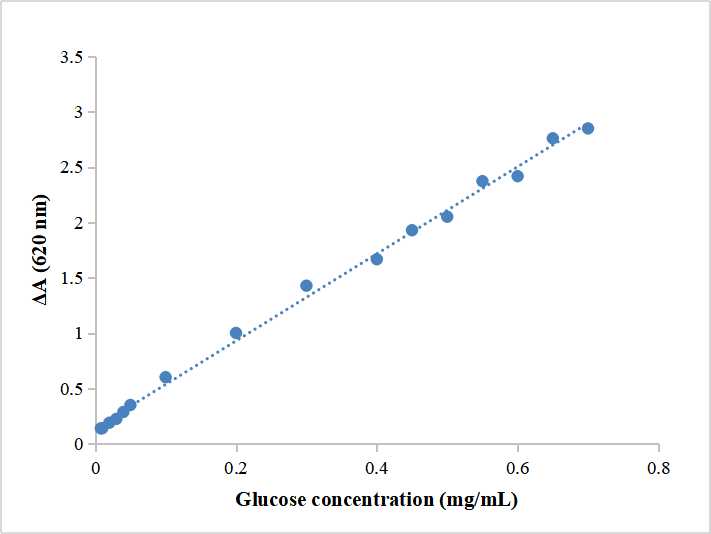
- Standardarbeitslösung: verdünnen 10 mg/mL-Standardlösung mit destilliertem Wasser auf 0.4, 0.2, 0.1, 0.05, 0.04, 0.03, 0.02, 0.01 mg/ml.
- Standardtest: Nehmen 50 μL Standardlösung oder 50 μL destilliertes Wasser (Leeres Rohr) Und 250 μL Arbeitslösung in EP-Röhrchen geben. In ein 95°C warmes Wasserbad stellen 10 Protokoll (Ziehen Sie den Deckel fest, um Wasserverlust zu vermeiden), natürlich auf Raumtemperatur abkühlen, nehmen 200 μL in Mikroglasküvette/96-Well-Flachbodenplatte, Bestimmen Sie die Absorption der Standardlösung(ALS) und Blankkontrolle(AB) bei 620 nm. Berechnen Sie ΔA=AS — AB. Blindrohr und Standardkurve müssen nur ein oder zwei Mal getestet werden.
- Mustertest: Nehmen 50 μL Probe und 250 μL der Arbeitslösung für EP in ein 95℃-Wasserbad geben 10 Protokoll (Ziehen Sie den Deckel fest, um Wasserverlust zu vermeiden), natürlich auf Raumtemperatur abkühlen lassen, nehmen 200 μL in Mikroglasküvette/96-Well-Flachbodenplatte, Bestimmen Sie die Absorption des Reagenzglases(BEI) bei 620 nm. Berechnen Sie ΔAˊ= AT — AB.
III. Berechnungen:
- Erstellen Sie eine Standardkurve
Nehmen Sie eine Glukose-Standardlösung (0.4, 0.2, 0.1, 0.05, 0.04, 0.03, 0.02, 0.01 mg/ml) als x-Achse, ΔA als y-Achse, um die Standardkurve zu zeichnen und die lineare Regressionsgleichung y=kx+b zu erhalten, Das Einsetzen von ΔAˊ in die Gleichung ergibt x(mg/ml).
- Berechnung des Stärkegehalts. Berechnet anhand der Masse des Stärkegehalts der Probe (mg/g Masse) = x×F×VE÷W÷1,11=1,351x÷W×F VE: Volumen nach der Extraktion, 1.5 ml;
W: Probenmasse, G;
F: Verdünnungsverhältnis;
1.11: ist die Konstante zur Umwandlung des mit dieser Methode gemessenen Glukosegehalts in Stärkegehalt, das ist, 111
μg Glucose werden durch Anthronreagenz gefärbt, was gleichbedeutend mit ist 100 μg Stärke durch Anthronreagenz.
Notiz:
- Da das Arbeitsmedium stark korrosiv ist, Bitte bedienen Sie mit
- Wenn der Absorptionswert den linearen Bereich überschreitet, Die Probenmenge kann vor der Bestimmung erhöht oder verdünnt werden.
Experimentelles Beispiel:
- Nehmen Sie 0,05 g Mais zur Probenbehandlung, Nimm den Überstand, und dann gemäß den Bestimmungsschritten vorgehen. Verwenden 96 Wellplatte zur Messung und Berechnung von ΔA′=AT-AB= 0.728-0.622 =0,195, Standardkurve y = 3,1829x + 0.002, Berechnen Sie x = 195. Stärkegehalt (mg/g Masse) = 1,351x×F÷W= 1,351×0,195 × 128÷0,05 = 674.4 mg/g Masse.
Verweise
- Clegg K M. Die Anwendung des Anthronreagens zur Bestimmung des Stärkegehalts in Getreide[J]. Zeitschrift für Ernährungs- und Landwirtschaftswissenschaft, 1956, 7(1):40-44.
- Viles Jr, Silverman L. Bestimmung von Stärke und Cellulose mit Anthron [J]. Analytische Chemie, 1949, 21(8):950-953.
Verwandte Produkte
BC0610/BC0615 Boden-β-Glucosidase (B- GC) Aktivitätstest-Kit
BC2040/BC2045 β-Amylase-Aktivitätstest-Kit
BC1850/BC1855 Lösliche Stärkesynthase(SSS) Aktivitätstest-Kit



Rezensionen
Es gibt noch keine Rezensionen.