Reduzierter Glutathion (GSH) Inhaltstest-Kit
Notiz: Nehmen Sie vor dem Test zwei oder drei verschiedene Proben zur Vorhersage.
Betriebsausrüstung: Spektrophotometer/Mikroplattenleser
Katalognummer: BC1175
Größe: 100T/96S
Komponenten:
Reagenz I: 100 ml×1. Speichern Sie bei 4 ℃.
Reagenz II: 20 ml×1. Speichern Sie bei 4 ℃.
Reagenz III: 8 ml×1. Speichern Sie bei 4 ℃, vor Licht schützen.
Standard: Pulver 10 mg × 1. Speichern Sie bei 4 ℃, vor Licht schützen.
Produktbeschreibung
Glutathion ist ein natürliches Tripeptid, das aus Glutaminsäure besteht (Glu), Cystein (Cys) und Glycin (Gly). Es ist eine Art von Verbindung, die die Sulfhydrylgruppe enthält (-Sch), das existiert im Tiergewebe weit verbreitet, Pflanzengewebe, Mikroorganismus, und Hefe. Glutathion kann mit 5,5 reagieren′-Dithiobis-(2-Nitrobenzoesäure) (Dtnb) 2-nitro-5-mercaptobenzoesäure und Glutathiondisulfid produzieren (GSSG). 2-Nitro-5-Mercaptobenzoesäure ist ein gelbes Produkt, mit der maximalen Absorption bei 412 nm.
Technische Spezifikationen
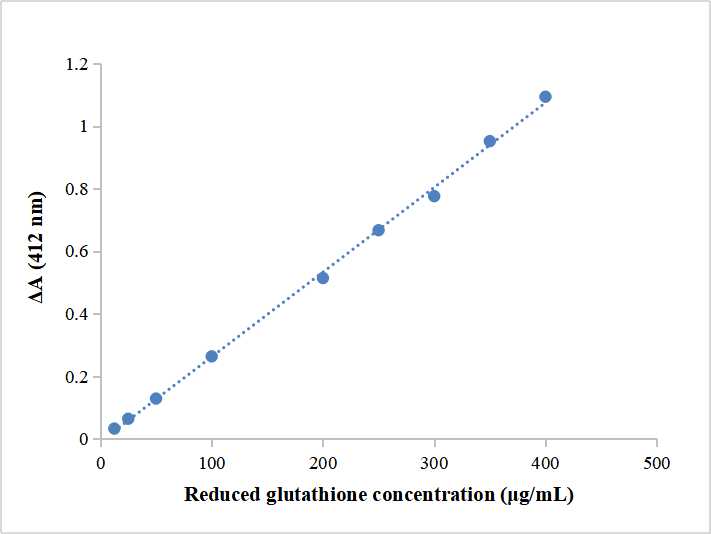
Mindesterkennungsgrenze:3.763 μg/ml
Linearer Bereich:12.5-400 μg/ml
Erforderliche, aber nicht bereitgestellte Reagenzien und Ausrüstung
Analytisches Gleichgewicht, Mörtel/Homogenisator, Niedrige Temperaturzentrifuge, Wasserbad, verstellbare Pipette, Spektrophotometer/Mikroplattenleser, Mikroglasklugette oder 96 gut flache Bodenplatte und destilliertes Wasser.
Verfahren
ICH. Probenvorbereitung
- Gewebeprobe
Waschen Sie frische Gewebe mit PBS für zweimal, dann hinzufügen 0.1 G von Tier-/Pflanzengewebe in Homogenisator (Der Homogenisator wurde mit Reagenz I gespült und vor dem Gebrauch auf Eis gelegt). Hinzufügen 1 ml Reagenz I (Der Anteil von Gewebe und Reagenzien kann konstant gehalten werden), Volles Schleifen auf Eis (Die Verwendung von flüssigem Stickstoff hat einen besseren Schleifeffekt). Zentrifuge bei 8000 ×g für 10 Minuten bei 4 ℃, Nehmen Sie den Überstand und platzieren Sie ihn bei 4 ℃ zur Prüfung. (Wenn der Test nicht vorübergehend abgeschlossen werden kann, Der Überstand kann bei -80 ℃ für aufbewahrt werden 10 Tage.)
- Blutprobe
Plasma: Die Probe ist zentrifugiert bei 600 ×g für 10 Minuten bei 4 ℃. Das obere Plasma in ein anderes Röhrchen aufnehmen, indem das gleiche Volumenreagens i hinzugefügt wird i. Zentrifuge bei 8000 ×g für 10 Minuten bei 4 ℃, Nehmen Sie den Überstand und platzieren Sie ihn bei 4 ℃ zur Prüfung. (Wenn der Test nicht vorübergehend abgeschlossen werden kann, Der Überstand kann bei -80 ℃ für aufbewahrt werden 10 Tage.)
Blutkörperchen: Die Probe ist zentrifugiert bei 600 ×g für 10 Minuten bei 4 ℃. Das obere Plasma wegwerfen, Waschen Sie mit dreimaliger Volumen von PBS für 3 mal (Blutzelle mit PBS neu ausführen, Zentrifuge bei 600 ×g für 10 Protokoll), Fügen Sie das gleiche Volumen des Reagenzs hinzu i. Nach dem Mischen, es wird bei 4 ℃ für platziert 10 Protokoll. Zentrifuge bei 8000 ×g für 10 Protokoll, Nehmen Sie den Überstand und platzieren Sie ihn bei 4 ℃ zur Prüfung. (Wenn der Test nicht vorübergehend abgeschlossen werden kann, Der Überstand kann bei -80 ℃ für aufbewahrt werden 10 Tage.)
3. Zelle Probe
Die Erntezelle sollte mindestens 106 und dann mit PBS für zweimal waschen (Die Zelle mit PBS neu ausführen, Zentrifuge bei 600 ×g für 10 Protokoll). Das Volumen des Reagens, das ich hinzugefügt habe. 2–3 Mal wiederholtes Gefrieren und Auftauen (Es wird vorgeschlagen, dass in flüssigem Stickstoff eingefroren ist, in 37 ℃ Wasserbad gelöst). Zentrifuge bei 8000 ×g für 10 Protokoll, Nehmen Sie den Überstand und platzieren Sie ihn bei 4 ℃ zur Prüfung. (Wenn der Test nicht vorübergehend abgeschlossen werden kann, Der Überstand kann bei -80 ℃ für aufbewahrt werden 10 Tage.)
II. Verfahren
- Vorheizen -Spektrophotometer/Mikroplattenleser für 30 Protokoll, Passen Sie die Wellenlänge an 412 nm, Null mit destilliertem Setzen
- Reagens II in 37 ℃ vorheizen (Säugetierzelle) oder 25 ℃ (andere Arten) Wasserbad für 30
- Blindrohrbestimmung: Nehmen Sie die Mikroglas -Küvette, hinzufügen 20 μL destilliertes Wasser, 140 μl von Reagenz II II, 40 μl Reagenz III wiederum, gut mischen, Ort für 2 Protokoll, und messen 412 NM Absorption AB.
- Standardkurve machen
Wiegen 1 mg Standard und auflösen es mit 1 ml destilliertes Wasser, um die Konzentration von zu erhalten 1 mg/ml. Nehmen Sie die geeignete Lösung, um die Standards mit der Konzentration von vorzubereiten 200 μg/ml, 100 μg/ml, 50 μg/ml, 25 μg/ml und 12.5 μg/ml (Verdünnen Sie das Reagenz I zehnmal vor dem Verdünnen der Standardlösung).
Nimm a 1.5 ML EP -Röhrchen und hinzufügen 20 μl Standard, 140 μl von Reagenz II und 40 μl Reagenz III wiederum. Nach jeder Röhre ist gleichmäßig gemischt, es darf für stehen 2 Protokoll. Messen Sie die Absorption bei 412 nm, und Absorption abzüglich AB als Abszisse. Machen Sie die Standardkurve gemäß der Absorption (X) und Konzentration (y, μg/ml).
- Probenrohrtest: Nehmen Sie die Mikroglas -Küvette, hinzufügen 20 μl der Probe, 140 μl von Reagenz II II, 40 μl Reagenz III wiederum, gut mischen, und dann steh für 2 Minuten, um die Absorption ATAT zu testen 412 nm, ΔA = at – AB.
- Der Betrieb des Mikroplattenlesers entspricht dem des Spektrophotometers, und die Operation ist so schnell wie
III. Berechnungen
Gemäß der Standardkurve, Nehmen Sie die Probe ΔA in die Formel(X), und berechnen Sie die Probenkonzentration y (μg/ml).
- Proteinkonzentration
GSH (μg/mg Prot)= y × vrv ÷ vrv ÷ cpr = y ÷ cpr
- Probengewicht
GSH (μg/g)= y × vrv ÷(VRV ÷ VSV × W.)= y ÷ w
- Zellmenge
GSH (μg/104Cell)= y × vrv ÷(VRV ÷ VSV × n)= y ÷ n
- Lösungsvolumen GSH (μg/ml)= 2y
N: Zellmenge, 106;
VSV: Gesamtüberstandsvolumen, 1 ml;
Kabel: Überstandsvolumen in das Reaktionssystem hinzugefügt, 20 μl = 0,02 ml; W: Probengewicht, G;
Cpr: Überstandsproteinkonzentration, mg/ml.
2: Das Volumen des Plasmas (Blutzellen) wird von einer Zeit verwässert.
Notiz:
- Die Probe muss vollständig homogenisiert werden. Wenn der Test nicht vorübergehend abgeschlossen werden kann, Es kann AT-80 ℃ gespeichert werden.
- Standard: Reduzierter Glutathion wird hergestellt, wenn die Lösung ausgeht
- Wenn der GSH -Inhalt in der Stichprobe ungewiss ist, Verdünnen Sie die Probe zuvor für mehrere Gradienten
- Weil Reagens ich Protein -Exsistent enthält, Der Überstand kann nicht zur Bestimmung der Proteinkonzentration verwendet werden. Wenn der Proteingehalt bestimmt werden muss, Nehmen Sie ein weiteres Gewebe.
Referenz:
- Alpert a j, Gilbert H f. Nachweis von oxidiertem und reduziertem Glutathion mit einer Recycling -Postkolumnreaktion[J]. Analytische Biochemie, 1985, 144(2):553-562.
- Owens C w i, Belcher r v. Ein kolorimetrisches Mikro-Methode zur Bestimmung von Glutathion[J]. Biochemisches Journal, 1965, 94(3):
Verwandte Produkte:
BC1180/ BC1185 Oxidiertes Glutathion (GSSG) Assay -Kit
BC1190/ BC1195 Glutathion Peroxidase Assay Kit
BC1150/ BC1155 Oxidiertes Thioredoxin -Reduktase oxidiert (TRXR) Assay-Kit
BC1210/ BC1215 γ-Glutamat-Cystein-Ligase (GCL) Assay Ki



Rezensionen
Es gibt noch keine Rezensionen.