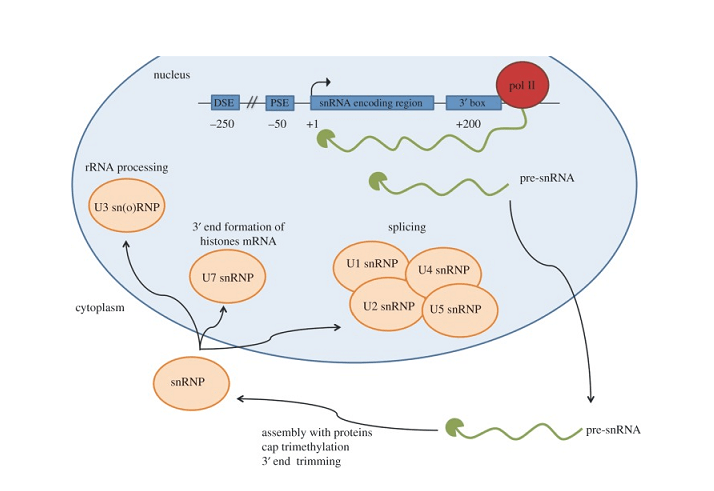
單核RNA, 或snRNA, 儘管長度較短,但在細胞內發揮至關重要的作用. 正如非編碼RNA分子僅在核中發現的, SNRNA參加了必不可少的轉錄後修飾,有助於合成功能蛋白. 有兩個主要類別的snrnas – U1, U2, U4, U5, 和形成小核核糖核蛋白的U6 (snrnps) 參與剪接, 以及H/ACA和C/D盒snornas,引導其他RNA的化學修飾.
什麼是單核RNA測序 (snrna-seq)?
單核RNA測序, 或snrna-seq, 是一種創新的技術,可分析從單個細胞中分離的核轉錄組. 這種方法有助於最大程度地減少轉錄壓力響應,從而在解離過程中會偏向結果. 與傳統的單細胞RNA測序相比 (scrna-seq), SnRNA-Seq具有某些優勢,可以增強其研究細胞異質性的效用.
snRNA-seq和scrna-seq之間有什麼區別?
單核RNA測序 (snrna-seq), 也稱為snRNA-seq或snuc-seq, 是一種創新的RNA測序方法,用於在細胞中介紹基因表達. 該技術是單細胞RNA測序的強大替代方案 (scrna-seq) 通過分析核而不是完整的細胞. 但是,與scrna-seq區分開的確切設置? 讓我們深入研究關鍵差異.
SCRNA-SEQ測量細胞質和核轉錄本, 提供細胞基因表達概況的全面視圖. 相比之下, SNRNA-Seq主要測量核轉錄本, 當它著重分析核本身內的RNA. 這種靶向方法最大程度地降低了偽基因表達的發生, 由於成熟的核醣體居住在細胞質中. 所以, 分離過程後表達的任何轉錄因子均無法翻譯, 防止其下游目標的轉錄.
snRNA-seq如何適應具有挑戰性的組織類型?
一個, SnRNA-Seq可容納更廣泛的組織類型,這些組織可能具有挑戰性地將其完全分離為單個細胞. 具有密集的細胞外基質等複雜組織像大腦, 腎, 由於其溫和的解離方案,可以使用SNRNA-Seq更有效地分析心臟. 這保留了敏感細胞類型的完整性,這些細胞類型可能會在SCRNA-SEQ所需的嚴格解離期間經歷轉錄變化或降解.
將SnRNA-Seq用於存檔樣品有什麼好處?
SnRNA-Seq還支持對存檔的臨床樣品的研究. 只要可以分離完整的核,就可以介紹與SCRNA-SEQ不兼容的冷凍或固定組織. 與需要新鮮隔離的單個細胞的其他測序方法相比,這擴大了可能的研究應用的範圍. 尤其, SNRNA-SEQ使研究人員能夠分析驗屍後人腦組織,以在單細胞水平上發現神經元的多樣性.
SnRNA-Seq提供什麼獨特的觀點?
而不是全面轉錄組的全面視圖, SNRNA-Seq提供了對核過程和相互作用的重點見解. 它提供了有關受限核空間內監管機制的獨特放大觀點. 將snRNA-seq應用於復雜的組織樣品已經揭示了新的細胞類型和狀態,這些細胞類型可能僅使用SCRNA-SEQ而未被發現. 這樣的發現加深了我們對細胞組織和專業化的理解, 擴展精密醫學的前沿.
snRNA-seq如何幫助具有挑戰性的樣品中的基因表達?
SNRNA-SEQ的核分析能力證明,對於使用常規的SCRNA-SEQ方法分析的樣本特別有價值. 某些組織類型構成技術困難,諸如密集矩陣組成之類的質量, 解離時脆弱性, 或與單細胞隔離所需的酶促處理不兼容. 通過固定保存的存檔樣品也帶來了挑戰.
SNRNA-SEQ如何用於研究哺乳動物心臟組織?
哺乳動物心臟組織例證了一個與SCRNA-SEQ棘手的系統,但可與SnRNA-Seq分析相提並論. 心肌細胞形成一個複雜的互連網絡,不容易破壞而沒有細胞損傷. 然而, 在 2020 德國研究人員成功地使用了SnRNA-Seq對第一個成人哺乳動物心臟進行了測序. 通過隔離核代替整個心肌細胞, 他們獲得了心肌內獨特細胞群的實際分佈. 通過SCRNA-SEQ方法,這種大規模分析將是不切實際的.
SNRNA-SEQ如何使神經元種群的研究受益?
神經元種群代表另一個從SNRNA-SEQ功能中受益的類. 大腦由複雜的有線神經元組成,因為完整的單細胞不容易解散. 試圖這樣做可以引起壓力反應歪曲結果. 然而,研究神經亞型的轉錄組異質性,可以為我們的神經生物學理解, 疾病機制, 和更多. 針對中樞神經系統組織優化的SNRNA-SEQ方案可在單細胞分辨率上保留存檔和新鮮切除的人腦樣品.
snRNA-seq如何實現冷凍臨床樣品的分析?
凍結的臨床樣品類似地施加了snRNA-seq克服的局限性. 肝病研究比較了通過SNRNA-SEQ檢測到的健康和纖維化肺核的研究表明,對組成細胞類型的鑑定無偏見. 由於SCRNA-SEQ輸入約束,以前對存檔的患者生物測量的這種分析被排除在分析之外. 現在,研究人員可以將“ OMICS Insight”應用於影響精度診斷和治療的多種現實樣本.
SNRNA-SEQ協議如何最小化轉錄擾動?
SnRNA-Seq的主要優勢在於其溫和的解離協議,該方案阻止了熱量引起的技術問題, 長時間的孵育時間或過度酶促處理. 簡介, 用於核分離的輕度裂解方法可以防止應力引起的轉錄變化,這可能會使SCRNA-SEQ結果偏斜. 沒有使完整的細胞進行嚴格的分離步驟, SNRNA-SEQ採樣更好地保留了分離時存在的轉錄本的完整性.
snRNA-seq如何最大程度地減少虛假基因表達模式?
這可以最大程度地降低由解離過程本身引起的虛假基因表達模式的發生. 僅在細胞質區室內發現的成熟核醣體意味著編碼立即反應後反應基因表達的任何mRNA都無法翻譯. 因此,它們的下游轉錄目標保持不變. 將這兩種技術應用於同一組織的比較研究表明,SNRNA-Seq捕獲了更廣泛的細胞類型的子集,其分離誘導的轉錄擾動較少.
短裂解持續時間如何幫助控制snRNA-seq中的轉錄組偏差?
諸如短裂解持續時間之類的其他因素有助於控制轉錄組偏見. 在進行單核圖書館製備之前,長時間在冰上暴露於冰上可能會通過啟動轉錄更改對數據質量產生負面影響. 仔細的時機緩解這種效果. 足夠的初始組織量還可以確保在方法論局限.
如何優化SNRNA-SEQ工作流程最小化技術工件?
全面的, 優化的SNRNA-SEQ工作流程最小化分析前因子復雜的生物學解釋. 它們對核含量的溫和提取的基因表達曲線比內源性生物學過程較少。. 這使發現有關監管網絡的發現更加清晰和信心, 罕見的亞群, 和復雜體內系統中的蜂窩專業計劃.
研究人員如何應用snRNA-seq來提高生物學理解?
作為一種創新技術,可以完善我們對細胞複雜性的看法, SnRNA-Seq為各種研究應用開放了新的邊界. 一些例子強調了它推動科學進步的潛力:
- 發展生物學: 比較不同胚胎階段的核可以揭示特定階段的調節程序指導分化. 空間分辨的snRNA-seq映射發育梯度可能會發現模式的機制.
- 疾病病理學: 分析疾病與健康組織核可能識別稀有細胞類型中與病理相關的變化,以照亮疾病機制. 患者樣品分析可以為精確診斷和治療學提供信息.
- 神經精神病學: 通過snRNA-seq研究存檔的驗屍後腦組織有助於表徵精神病的神經多樣性. 縱向研究可能會發現縱向生物標誌物和治療靶標.
- 進化研究: SnRNA-Seq使可行的跨物種比較以前由於組織特性的差異而挑戰. 這樣的 “phylo-snRNA-seq” 告知我們對保守與發散的監管過程的理解.
- 多摩斯集成: 將SnRNA-Seq與空間分析技術配對產生空間分辨的表觀基因組學和轉錄組圖,闡明了核微環境. 將空間成績單數據與蛋白質組學或代謝組層集成在一起提供系統層面的上下文.
概括
作為幾種徹底改變單細胞分析的新興技術之一, SnRNA-Seq催化劑通過使以前難以置信的樣品實驗性地進行催化. 它擴展的核武器有望將新的見解從再生醫學到精確腫瘤學發展的各種領域. 以及互補的方法, snRNA-seq在前所未有的水平上幫助揭開生活的迷人復雜性.