- 試劑盒的組成
| 規格 | 50時間 | 100時間 |
| 貓. 不. | SN0201 | SN0202 |
| DNA萃取柱 (放) | 50 (放) | 100 (放) |
| 試劑緩衝液A | 30 毫升 | 2 × 30 毫升 |
| 試劑緩衝液C | 30 毫升 | 2 × 30 毫升 |
| 洗滌緩衝液 1 | 15 毫升 | 2 × 15 毫升 |
| 核糖核酸酶A | 1毫升 | 1毫升 |
| 洗脫緩衝液 | 20 毫升 | 20 毫升 |
| 使用說明書 | 1 | 1 |
- 貯存
該套件應在室溫下保存 (15-25℃) 乾燥條件下可保存 12 月. DNA萃取純化柱可在陰涼乾燥的環境中保存長達 1 年. RNase A 含有防腐劑,可在室溫下運輸, 但為了長期儲存, 應保存在-20℃.
- 試劑盒使用說明
3.1 該試劑盒旨在用於分子生物學研究目的,不應用於疾病診斷或治療.
3.2 套件中的某些成分含有刺激物; 建議採取必要的預防措施 (例如穿著防護衣和護目鏡).
3.3 使用該套件需要額外的設備,例如高速離心機, 水浴 (金屬浴), 渦旋混合器, 無水乙醇, 液態氮, 氯仿, 無菌去離子水, 和EP管.
- 試劑盒簡介
這 CTAB-基地工廠 DNA純化 試劑盒提供了一種改良的 CTAB 純化 DNA 方法, 利用可有效沉澱 DNA 的特異性結合緩衝液, 隨後透過吸附管柱收集高純度DNA.
此試劑盒廣泛用於植物組織和真菌, 能夠從樣本中萃取總DNA 2 小時 (包括粒線體DNA和葉綠體DNA). 萃取的DNA可直接用於下游實驗,例如 聚合酶鍊式反應, 南方印跡, 和別的.
- 實驗原理和程序
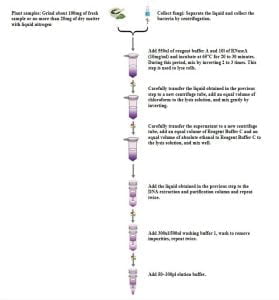
- 提取過程
開始實驗前的注意事項:
- 試劑緩衝液 A 和 C 低溫條件下可能會沉澱. 建議加熱至65°C 5 分鐘,待沉澱溶解後使用.
- 洗緩衝 1 應依照瓶子標籤上的指示添加指定量的無水乙醇. 加入乙醇後標記標籤.
- 洗脫緩衝液是 0.1x TE 解決方案含有極少量的 EDTA. EDTA是否影響後續實驗, 建議使用無菌去離子水代替洗脫緩衝液.
- 樣品處理:
- 材料收集和儲存:
新鮮收集的材料, 如果不立即使用, 應置於液態氮中並最終儲存於-80°C. 乾燥後的物料可在室溫下保存.
- 如果可能的話, 收集新鮮材料,因為它含有較少的多醣和多酚.
- 從液體培養物中收集真菌時, 離心分離液體並收集真菌體.
- 磨周圍 100 mg 新鮮樣品或不超過 20 使用液態氮乾燥材料的毫克數.
(筆記: 不同的樣品量可能需要在使用前透過初步實驗進行最佳化.)
- 添加 550 µl 試劑緩衝液 A 和 10 µl RNase A (10 毫克/毫升) 確保研磨樣本中沒有組織團塊. 組織團塊難以裂解並會降低 DNA 產量. 請勿混合 試劑緩衝液 A 和 RNase A使用前.
- 65°C 下孵育 20-30 分分鐘, 輕輕翻轉 2-3 次. 此步驟用於細胞裂解.
- 將裂解液離心 5 分鐘在 14,000 轉速 (20,000×g).
(筆記: 有些植物材料在這一步驟可能會有許多黏性物質, 可以在後續步驟中剪切 DNA. 理想情況下, 離心後將上清液轉移至新的離心管中以去除這些物質.)
- 小心地將上一步所得的液體轉移至新的離心管中.
(筆記: 大約 500 可轉移μl液體; 對於某些物種, 它可能小於 500 微升.)
- 在裂解液中加入等體積的氯仿,輕輕顛倒混勻.
(筆記: 例如, 添加 500 µl 氯仿(如果有) 500 µl 裂解液. 如果裂解液體積小於 500 微升, 相應調整氯仿體積.)
- 離心機在 12,000 轉速為 10 分分鐘.
- 小心地將上清液轉移至新的離心管中 (大約 500 微升).
- 加入等體積的 試劑緩衝液C 和與裂解液等體積的無水乙醇, 並混合.
(例如, 如果你添加 450 µl 試劑緩衝液 C, 然後加 450 微升無水乙醇. 如果裂解液體積小於 450 微升, 比例減少試劑緩衝液 C 的量. 加入試劑緩衝液C後會出現一些沉澱, 但不影響後續實驗.)
- 將所得的液體轉移至DNA純化柱 (成套工具), 大約 650-700 每次μl. 離心機超過 8,000 轉速為 1 分分鐘, 丟棄收集的廢棄物, 並將收集管重新插入純化管柱進行下一步.
- 重複步驟 11, 將剩餘液體加入 DNA 純化管柱中 (成套工具) 並在超過 8,000 轉速為 1 分分鐘. 丟棄廢棄物和收集管.
- 放置 DNA 純化柱 (成套工具) 放入新的收集管中, 添加 300 微升的 洗 緩衝 1, 離心機超過 8,000 轉速為 1 分分鐘, 丟棄廢棄物, 並重新插入DNA純化管柱 (成套工具) 進入管中進行下一步.
(筆記: 確保已添加無水乙醇 洗 緩衝 1.)
- 添加 500 µl 沖洗緩衝液 1 至 DNA 純化柱 (成套工具), 離心機在 14,000 轉速 (20,000×g) 為了 2 分分鐘, 稍微延長離心時間以獲得乾燥的膜.
- 放置 DNA 純化柱 (成套工具) 放入新的離心管中, 打開, 並在 65°C 下加熱 2 分分鐘. 此步驟可延長,盡可能蒸發乙醇,防止殘留乙醇影響下游實驗.
- 滴 100 µl 洗脫緩衝液到膜上, 離心機在 12,000 轉速為 2 分分鐘.
(筆記: 1. 洗脫 DNA 50 µl 洗脫緩衝液可增加 DNA 濃度,但會降低總 DNA 產量. 2. 洗脫液可重新上樣至 DNA 純化管柱進行第二次洗脫, 離心機在 12,000 轉速為 2 分鐘收集, 這可能會提高 DNA 產量.)













評論
還沒有評論.