研究について
現在QRTで内部参照遺伝子が使用されています-PCR ユビキチン結合酵素のようなさまざまな遺伝子を含めます (UBC), リボソームRNA (rrna), 伸長因子1-アルファ (EEF1-α), リボソームタンパク質 (RPL), アルギニンキナーゼ (そして), グリセルアルデヒド-3-リン酸デヒドロゲナーゼ (gapdh), アクチン, およびチューブリン. さまざまな種や条件がこれらの参照遺伝子の安定性の変動を示すため、それらの安定性を評価することが重要です.
Callosobruchus属には、ササギゾウムシのような害虫が含まれています, ムンゲンや赤豆などのマメ科作物の種子に損傷を与える. これらのゾウムシは、畑の柔らかい豆のポッドに卵を産みます, 幼虫がhatch化するとき, 彼らは豆にトンネルします. 卵と幼虫は、収穫後も貯蔵に入ることができます, 感染の第2波を引き起こします, 迅速に制御されなければ、これはより深刻になる可能性があります. これらの害虫は隠れています, 幅広い分布を持っています, そして、繰り返し感染を引き起こす強い能力を持っています, ムンゲンや赤豆などのマメ科作物の収量と品質に大きな影響を与える. これらのゾウムシの遺伝子発現に関する研究がありますが, 内部参照遺伝子の探索は不完全なままです. この研究では、以前の実験室研究に基づいて8つの候補内参照遺伝子を特定しています: A-Tubulin, B-チューブリン, β-アクチン, 伸長係数 (EEF1-α), アルギニンキナーゼ (そして), 熱ショックタンパク質 70 (HSC70), グリセルアルデヒド-3-リン酸デヒドロゲナーゼ (gapdh), およびリボソームタンパク質 40 (RPL40). これらの遺伝子は、QRT-PCRを使用して発現レベルについて評価されました. Genormを通して, Normfinder, ベストキーパー, オンラインツールReffinder, ΔCT値とともに, この研究では、wo病のさまざまな発達段階および成体ゾウムシのさまざまな組織におけるこれらの候補内参照遺伝子の発現安定性を調査します. この研究の目的は、ササゲのゾウムシの遺伝子発現と機能に関する将来の研究のために信頼できる内部参照遺伝子を提供することを目的としています.
テストについて
キットを使用して、総RNAをセノ動物組織から抽出しました.
さまざまな発達段階および成体ゾウムシ組織のサダカ玉のさまざまな組織を使用して、Hiscript®III1st鎖を使用してcDNAを合成するために使用しました。 cDNA合成 キット (+GDNAワイパー).
このプロセスは、キットの指示に続いて3回繰り返されました. 抽出された総RNAの濃度と品質は、分光光度計およびアガロースゲル電気泳動を使用してチェックされました.
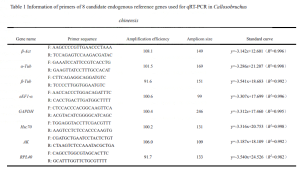
8つのタンパク質コーディング遺伝子 (β-act, βソン, αサン, そして, gapdh, RPL40, HSC70, EEF1-α) 候補遺伝子として選択されました.
定量的プライマーは、ビーコンデザイナーを使用して設計されました 7 ソフトウェアとバイオテクノロジー会社によって合成されました.
cDNAテンプレートはaで希釈されました 1:10 QRT-PCR反応のために5つの濃度を作成する勾配, 標準曲線の構築, プライマー増幅効率の計算e.
QRT-PCRの結果は、プライマーの標準曲線をプロットするために使用されました, 増幅効率Eは標準曲線の勾配を使用して計算されました (E = (10^-1/slope^-1) × 100).
QRT-PCR反応混合物 (20 μL) Chamq Universalで構成されています SYBR QPCRマスターミックス (10 μL), DDH2O (8.2 μL), PCRフォワードプライマー (0.4 μL, 10 μmol/L), PCRリバースプライマー (0.4 μL, 10 μmol/L), およびcDNA (1 μL). 反応条件はそうでした: forで95℃での初期変性 30 s; 40 forで95の変性のサイクル 10 s, 60のアニーリング/拡張 30 s; と融解曲線から 60 95℃へ 30 s. QRT-PCRの増幅および融解曲線が確認されました. 各サンプルは3回の技術的な複製を受けました.
QRT-PCR CT値からのデータは、CTを使用して分析されました, 標準化 (Water Company et al。, 2002), ベストキーパー (Pfaffl et al。, 2004), とnormfinder (Andersen et al。, 2004). CTとBestKeeperは、生のCT値を使用しました, 一方、GenormとNormfinderはデータを2^ - △ctに変換しました. CTは標準偏差を計算しました (SD) 安定性のランキングのための各候補参照遺伝子ペア間のCT値の違い - より安定した遺伝子を示すスマラーSD. Genormランク付けされた候補は、安定性値を使用して遺伝子の安定性を参照します (M) 計算. m < 1.5, この遺伝子は、参照遺伝子選択に適していると考えられていました, M値が低いため、安定性が高いことを示します. さらに, Genormは、ペアワイズ変動値vを使用して、参照遺伝子の最適数を決定しました. VN/n+1値がしきい値を下回っている場合 0.15, Nは、参照遺伝子の最適数とみなされました, 補正のためにN+1番目の参照遺伝子を追加する必要がない. BestKeeperソフトウェアは、CT値の標準偏差に基づいて候補参照遺伝子の安定性を評価しました (SD), 分散係数 (cv), 相関係数 (CC[r]), および重要性レベル (p). SDの遺伝子 < 1 安定したと見なされました, SDおよびCV値が小さく、安定性が高いことを示しています. より高いCC[r] 価値, p < 0.05, 他の遺伝子とのより大きな相関があることを意味しました, コントロール遺伝子としてそれを良い候補にする. ついに, Reffinder, オンラインツール, 参照遺伝子の安定性を包括的に分析しました, 信頼性の高い複合ランキングインデックスを提供する - 低い値は、より安定した内部参照遺伝子を示しています.
QRT-PCRからの融解曲線分析により、8つの候補の内部参照遺伝子が確認されました (β-act, βソン, αサン, そして, gapdh, RPL40, HSC70, EEF1-α) 非特異的増幅はありませんでした, 後続の実験のための良好な特異性を実証する (形 1). 8つの候補の内部参照遺伝子の標準曲線の結果は、希釈勾配内で良好な線形関係を示しました, QRT-PCRの増幅条件を満たします.
結論
現在, 遺伝子発現研究は、主にQRT-PCRテクノロジーに依存しています, 一般的に参照遺伝子を使用して、サンプル検出中に導入されたエラーを修正します. 以前の研究では、細胞活動を維持するために不可欠なハウスキーピング遺伝子が異なる条件下で安定した発現パターンを示すと一般に想定していました, ユニバーサル参照遺伝子と見なされています.
しかし, ハイスループットシーケンスの進歩により, より多くの研究は、ハウスキーピング遺伝子が必ずしも安定しているとは限らないことを示唆しています. 最適な参照遺伝子は、多くの場合、異なる条件下で異なる種間で大きく異なります.
標的遺伝子の発現を研究するとき, 検証なしで以前に公開された参照遺伝子を使用すると、偏りのある結果につながる可能性があります. したがって、, 参照遺伝子を再選択することが不可欠です.
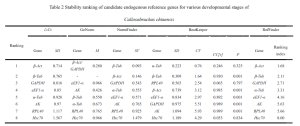
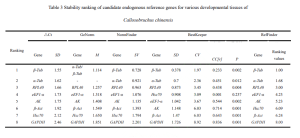
ササギゾウムシの場合, Genormソフトウェアのペアワイズ差分析のペアワイズバリエーション値VN/N+1は、のデフォルト値よりも一貫して低いことがわかりました 0.15 さまざまな発達段階と成体のゾウムシのさまざまな組織を超えて. したがって, データ修正のために3番目の参照遺伝子を含める必要はありません; 参照遺伝子の最も適切な数は2つです. CTによる包括的な評価, 標準化, Normfinder, ベストキーパー, また、Reffinder Onlineツールは、wo婦ゾウムシのさまざまな発達段階にわたる遺伝子発現研究のために、β-ACTおよびβタブを内部参照遺伝子として使用することを提案します. 同様に, 成体ゾウムシのさまざまな組織の場合, β槽とαタブは、内部参照遺伝子として推奨されました.
RPL40は、成体のササゲの異なる組織の内部参照遺伝子の1つとして使用するのに比較的適していると評価されました。. しかし, それは、ゾウムシの異なる発達段階の中で最も安定した遺伝子の1つであるように見えました.
一方で, GAPDHは、成人のササゲゾウムシの異なる組織間で発現の安定性が最も低く、ゾウムシの異なる発生段階での遺伝子発現研究の参照遺伝子としても不適切でした。. Colaphellus BowringiやSympiezomias velatusなどの他の甲虫目昆虫でも同様の結果が観察されました (So et al。, 2015; Li et al。, 2018).
この研究は、QRT-PCRを使用して、さまざまな発達段階およびササギゾウムシのさまざまな組織の遺伝子発現レベルを正確に分析するための正確で信頼できる内部参照遺伝子を提供します. しかし, これらの調査結果が他の実験条件に適用されるかどうかには、さらなる調査が必要です.
ササギゾウムシの内部参照遺伝子の発現は、実験条件が異なると大きく異なります. この研究では、5つの方法を利用して、さまざまな発達段階とwe骨ゾウムシのさまざまな組織における8つの候補内参照遺伝子の発現安定性を評価しました。. 結果は、Genormソフトウェアが異なる条件下でV2/3遺伝子ペアワイズ差値を計算したことを示唆しています, これらはすべてのしきい値を下回っていました 0.15. したがって, 相対遺伝子発現を研究するための参照遺伝子の最適数は2つです. 具体的には, ササギゾウムシのさまざまな発達段階の場合, β-actおよびβタブを内部参照遺伝子として使用することをお勧めします. その間, 成体ゾウムシのさまざまな組織の場合, βタブとαタブは、内部参照遺伝子として推奨されます.
