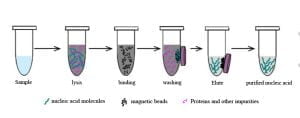
El procedimiento qPCR para la detección de Chlamydia implica dos pasos principales: Extracción de ADN y posterior amplificación y examen del ADN.. Inicialmente, Nos centraremos en compartir el contenido de aprendizaje relacionado con la extracción de ADN.. Este artículo profundiza principalmente en los fundamentos teóricos y una introducción a los reactivos utilizados..
Principios teóricos de purificación de la extracción de ADN. Antes de realizar experimentos., comprender los principios fundamentales y los procedimientos operativos es beneficioso. Nos ayuda a comprender el experimento., prever resultados potenciales, y evitar ser simplemente un operador repetitivo.
Principios básicos de la extracción de ADN.
Integridad de la estructura del ADN.: Por ejemplo, El principio detrás de la detección de Chlamydia basada en sondas qPCR implica la detección específica de Chlamydia mediante la amplificación de la región codificante de 16SrRNA en el genoma de Chlamydia.. La amplificación específica de Chlamydia se puede detectar a 520 nm. (canal familiar). El ADN incompleto de Chlamydia no se sometería a la amplificación y detección características.
Consideraciones:
(1) Para asegurar esto, Nuestros procedimientos experimentales deben implicar un manejo suave para evitar la degradación del ADN..
(2) Se debe prestar atención a la inactivación de las ADNasas..
(3) Si solo adquirimos el kit de reactivos qPCR Chlamydia sin el correspondiente kit de reactivos de extracción, No solo necesitamos probar la aplicabilidad del kit de prueba, sino también validar la efectividad de nuestro proceso de extracción..
1.1.2 Pureza del ADN: Esforzarse por eliminar otras sustancias moleculares grandes que puedan interferir con el ADN., evitando así cualquier impacto en experimentos posteriores. Asegúrese de que la muestra extraída no contenga disolventes orgánicos ni altas concentraciones de iones metálicos que inhiban las enzimas..
Consideraciones:
(1) Se aplican consideraciones similares al limitar el recuento total de células en muestras de células., ya que el ADN no objetivo dentro de otras sustancias moleculares grandes puede afectar el experimento.
(2) Una nota de precaución para el control de calidad (control de calidad): El muestreo no debe ser excesivo.. Si bien es posible que desee aumentar el volumen de la prueba para lograr representatividad en el control de calidad, Se debe tener precaución en tales casos..
(3) Es importante entender nuestras muestras.; si contienen disolventes orgánicos o iones metálicos que inhiben las enzimas, Necesitamos confirmar si estas sustancias se pueden eliminar eficazmente antes del experimento o si sus concentraciones se pueden reducir mediante métodos de cultivo celular..
(4) La contaminación por otros ácidos nucleicos es un factor de interferencia común..
Particularmente, al manipular clamidia o agitar en vórtex muestras positivas de clamidia, Se pueden generar aerosoles.. Por eso, durante el examen de clamidia, Las operaciones asépticas estrictas dentro de un gabinete de bioseguridad son cruciales., y se recomienda una centrifugación rápida después de agitar.